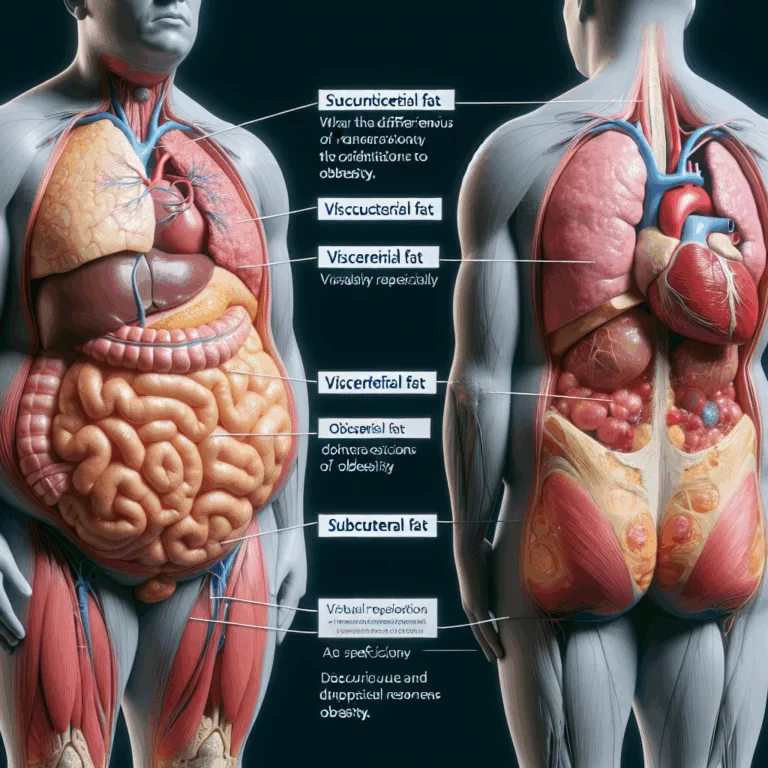
Les Réactions Différentielles de la Graisse Viscerale et Sous-Cutanée à l’Obésité
Les scientifiques ont découvert que la graisse viscérale, qui s’accumule autour des organes dans l’abdomen, et la graisse sous-cutanée, qui s’accumule sous la peau, réagissent différemment à l’obésité chez les souris mâles et les patients humains, et ont identifié un régulateur clé de ces processus. Des études épidémiologiques ont montré une corrélation plus forte entre…