La sénescence cellulaire et son impact sur la santé cardiovasculaire : enjeux et perspectives
Découvrez comment la sénescence cellulaire influence les maladies cardiovasculaires et explorez des approches thérapeutiques innovantes.
Découvrez comment la sénescence cellulaire influence les maladies cardiovasculaires et explorez des approches thérapeutiques innovantes.

Découvrez les résultats prometteurs de l’essai de phase 1 du MZE782 de Maze Therapeutics, un nouvel espoir pour la phénylcétonurie et la maladie rénale chronique.
Lancement d’une collaboration stratégique Tolerance Bio et ZipCode Bio ont annoncé le lancement d’une collaboration stratégique en recherche et développement pour explorer de nouvelles méthodes de livraison de thérapies ciblant le thymus. Cette alliance combine l’expertise de Tolerance Bio en biologie thymique et en immunologie avec la plateforme de livraison d’ARN SHARP (Single-component Homogeneous Amphiphilic…

Introduction Les chercheurs ont présenté une approche innovante pour rediriger le système immunitaire afin de détruire les cellules indésirables. Les membranes des cellules mortes possèdent des marqueurs distinctifs que les cellules immunitaires peuvent reconnaître, ce qui est essentiel pour leur fonction d’élimination des cellules mortes et des débris cellulaires, contribuant ainsi à maintenir la fonctionnalité…

L’immunosénescence est un phénomène lié à l’âge qui désigne la diminution de la capacité du système immunitaire à remplir ses fonctions essentielles, telles que la défense contre les pathogènes, la destruction des cellules sénescentes et cancéreuses, ainsi que la participation à l’entretien normal des tissus. Le vieillissement du système immunitaire est souvent accompagné d’une inflammation…
Les conditions neurodégénératives sont étroitement liées à l’inflammation chronique associée au vieillissement, ce qui nuit à la structure et à la fonction des tissus. De nombreuses preuves indiquent que la fonctionnalité dysrégulée des cellules immunitaires dans le cerveau contribue de manière significative à la pathologie. Cependant, le signalement inflammatoire est complexe, et il est difficile…

HAYA Therapeutics, une start-up de biotechnologie spécialisée dans la médecine de précision, a récemment levé 65 millions de dollars lors d’un financement de série A pour faire avancer le développement de médicaments guidés par l’ARN, ciblant les maladies chroniques et liées à l’âge en modulant le génome régulateur. Ce financement permettra à l’entreprise d’accélérer les…
Ce texte traite des protéines dans le corps qui peuvent se malplier et former des agrégats, ce qui nuit au fonctionnement normal des cellules. Ces agrégats peuvent causer des dommages directs ou induire une réponse inflammatoire néfaste. La recherche sur ces agrégats protéiques se concentre principalement sur le cerveau vieillissant et les maladies neurodégénératives, qui…
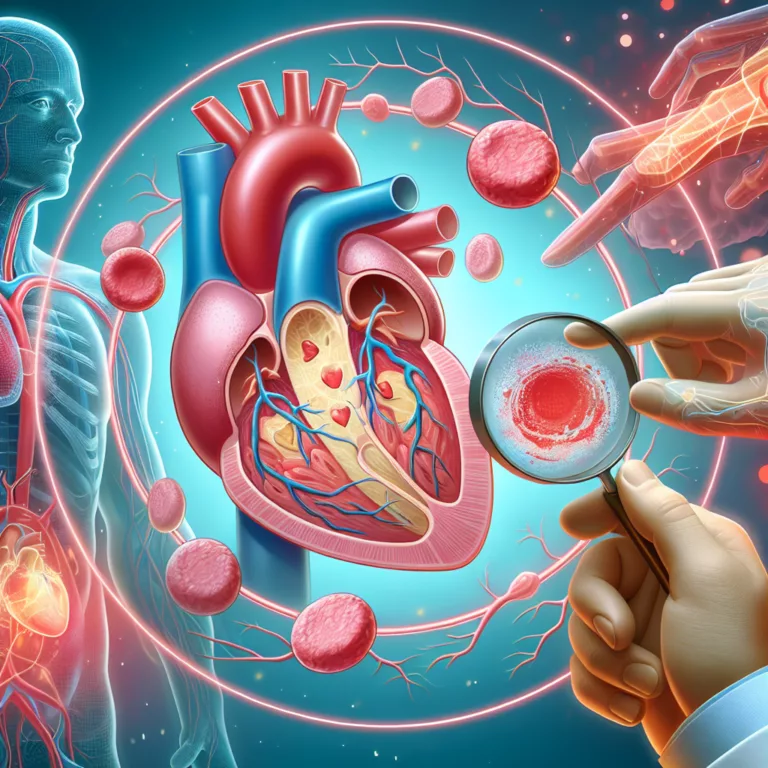
Les macrophages, des cellules essentielles du système immunitaire inné, se trouvent dans divers tissus du corps, y compris le cœur, et remplissent de nombreuses fonctions vitales. Ils ne se contentent pas de détecter et d’éliminer les agents pathogènes et les cellules potentiellement nuisibles, mais ils jouent également un rôle crucial dans la régénération après une…
Les problèmes de dos chez les personnes âgées sont largement reconnus comme étant causés par une détérioration de la colonne vertébrale, notamment la dégénérescence des disques intervertébraux (IDD). Cette affection rend les disques moins élastiques, diminuant leur capacité à supporter des charges et à maintenir la colonne vertébrale. Les chercheurs ont découvert que la sénescence…