L’avenir prometteur des exosomes dérivés de cellules souches dans le tourisme médical
Découvrez comment les exosomes issus de cellules souches révolutionnent le tourisme médical et leurs applications dans diverses pathologies.

Découvrez comment les exosomes issus de cellules souches révolutionnent le tourisme médical et leurs applications dans diverses pathologies.

Minovia Therapeutics, une société biopharmaceutique israélienne axée sur la longévité, a annoncé son intention de devenir publique par le biais d’une fusion avec Launch One Acquisition Corp., une société d’acquisition à vocation spéciale (SPAC) orientée vers la santé. Cette fusion créera une nouvelle entité cotée en bourse, Mito US One, qui se concentrera sur l’avancement…
Les cellules sénescentes s’accumulent avec l’âge, entraînant des dysfonctionnements cellulaires et tissulaires. Leur élimination par des traitements sénolytiques a démontré des résultats prometteurs lors d’études sur des animaux, avec des essais cliniques humains qui montrent des résultats initiaux encourageants. Bien que ces cellules soient souvent perçues comme nuisibles, elles jouent également un rôle dans la…

La médecine régénérative se concentre sur le contrôle des cellules pour favoriser la régénération et le remplacement des tissus, en particulier dans le contexte de maladies liées à l’âge. Le paradigme R3, qui se compose de la réjuvénation, de la régénération et du remplacement, constitue un cadre essentiel pour comprendre les thérapies actuelles. La réjuvénation…
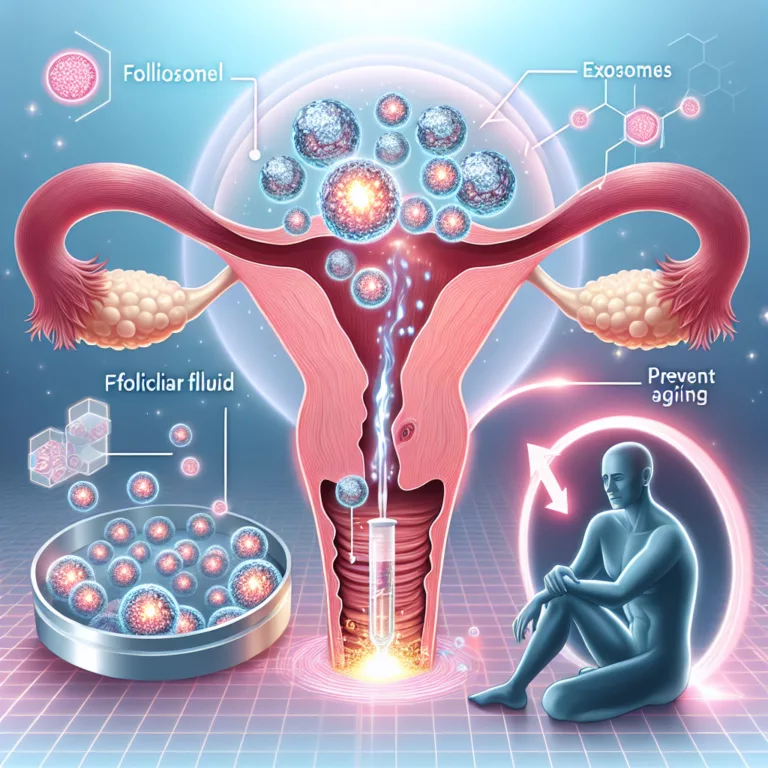
Les thérapies par cellules souches produisent des effets bénéfiques principalement grâce à la signalisation générée par les cellules transplantées pendant la courte période où elles survivent. Une grande partie de cette signalisation est transportée entre les cellules par des vésicules extracellulaires, comme les exosomes. Ces derniers peuvent être récoltés à partir de cellules en culture,…

La communauté clinique qui pratique les thérapies par cellules souches de première génération s’oriente progressivement vers la récolte des vésicules extracellulaires issues des cellules en culture, plutôt que vers les transplantations de cellules souches. Dans la plupart des cas, presque toutes les cellules souches transplantées meurent, et les effets de ces thérapies sur les maladies…