La sénescence cellulaire et son impact sur la santé cardiovasculaire : enjeux et perspectives
Découvrez comment la sénescence cellulaire influence les maladies cardiovasculaires et explorez des approches thérapeutiques innovantes.
Découvrez comment la sénescence cellulaire influence les maladies cardiovasculaires et explorez des approches thérapeutiques innovantes.
Une nouvelle étude révèle que, contrairement à de nombreux autres médicaments hypoglycémiants, la metformine est régulée par la protéine Ras1 dans un sous-ensemble spécifique de neurones. L’injection de petites doses de metformine dans le cerveau a montré des effets significatifs sur le métabolisme du glucose, ce qui remet en question les connaissances antérieures sur son…
La recherche sur les transfusions de fractions sanguines provenant de jeunes vers des individus âgés a montré des résultats variables chez les animaux et des résultats décevants dans les essais cliniques humains. Cependant, les chercheurs continuent à explorer les molécules présentes dans le sang jeune qui pourraient servir de base à des thérapies. Bien que…
Les microglies sont des cellules immunitaires innées du cerveau, comparables aux macrophages dans le reste du corps. Des recherches récentes montrent que le comportement inflammatoire maladaptatif des microglies dans le cerveau vieillissant joue un rôle crucial dans l’apparition et la progression de maladies neurodégénératives comme la maladie d’Alzheimer. Certaines microglies deviennent inflammatoires en réponse à…
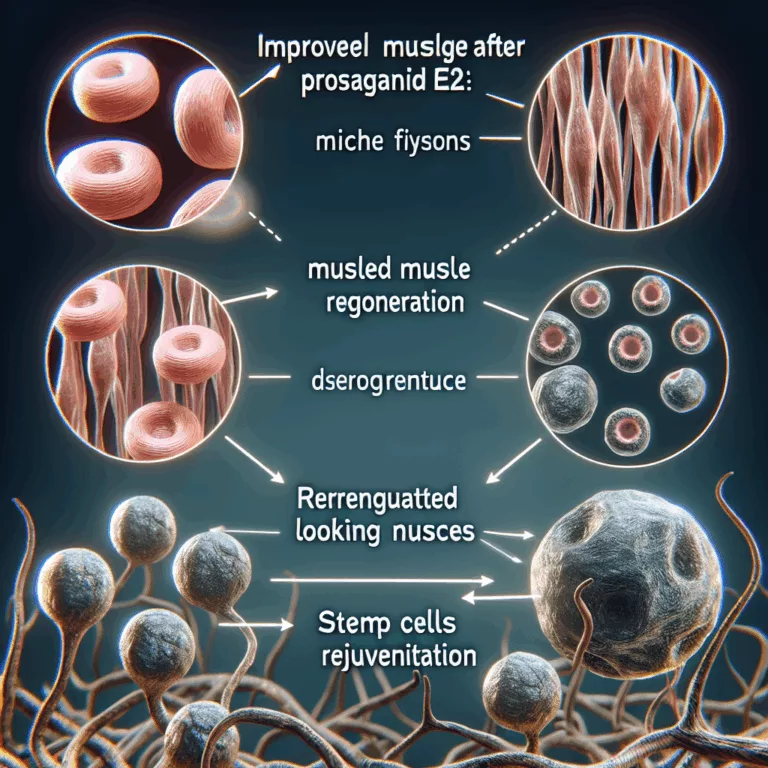
Une étude récente a examiné l’effet d’un traitement unique de prostaglandine E2 (PGE2) sur l’amélioration de la force musculaire et le rajeunissement des cellules souches musculaires chez des souris. Les chercheurs ont exploré les aspects moléculaires et épigénétiques sous-jacents à ce rajeunissement. La sarcopénie, une perte de masse et de force musculaire liée à l’âge,…
Les chercheurs se concentrent sur un mécanisme de signalisation qui diminue avec l’âge, notamment l’interaction entre la prostaglandine E2 (PGE2) circulante et son récepteur EP4 sur les cellules souches musculaires. Il a été observé que les niveaux de PGE2 et de son récepteur diminuent avec l’âge, ce qui semble altérer de manière générale la fonction…
La recherche sur la maladie d’Alzheimer (MA) se concentre sur les approches compensatoires visant à améliorer la capacité des cellules à fonctionner en dépit des dommages plutôt que de traiter directement ces dommages. Cela peut ralentir inévitablement la progression de la maladie, mais ne constitue pas une voie vers une thérapie curative. Les avancées majeures…
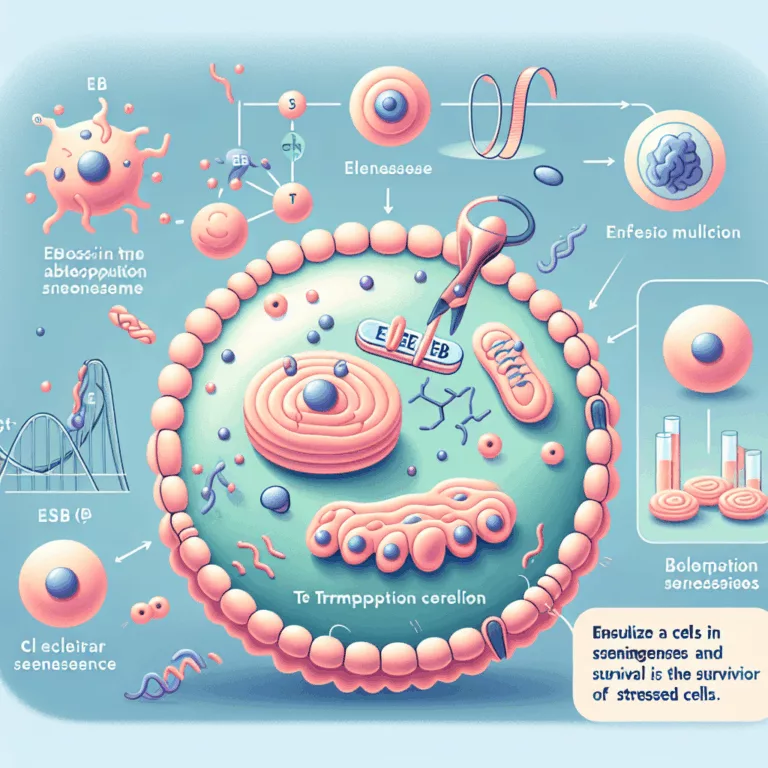
Dans cet article publié dans Aging Cell, les chercheurs explorent le rôle du facteur de transcription EB (TFEB) dans la sénescence cellulaire, en mettant en lumière son interaction avec le mécanisme de l’autophagie et le fonctionnement des lysosomes. Ils soulignent que le TFEB, lorsqu’il est inactivé par la voie de signalisation mTOR, a un impact…
Le gène klotho, en particulier l’α-klotho, est largement reconnu pour son association avec la longévité. Il code pour une protéine transmembranaire qui est exprimée dans plusieurs organes, libérant une partie de sa structure dans le sang et les tissus, où elle interagit avec d’autres cellules. Des études sur des modèles animaux montrent qu’une expression augmentée…

Mikhail Blagosklonny, un éminent scientifique, a profondément influencé le débat moderne sur les causes de l’âge, notamment par sa théorie de l’hyperfonction. Après sa mort, il est pertinent de réfléchir à ses contributions et à son dialogue avec d’autres chercheurs, tels qu’Aubrey de Grey. Blagosklonny a affirmé que l’hyperfonction, plutôt que l’accumulation de dommages, est…