Les Mystères des Cellules en Microgravité : Une Révolution Scientifique en Cours
Découvrez comment la microgravité influence la recherche sur les cellules souches et ses implications pour la médecine moderne.

Découvrez comment la microgravité influence la recherche sur les cellules souches et ses implications pour la médecine moderne.
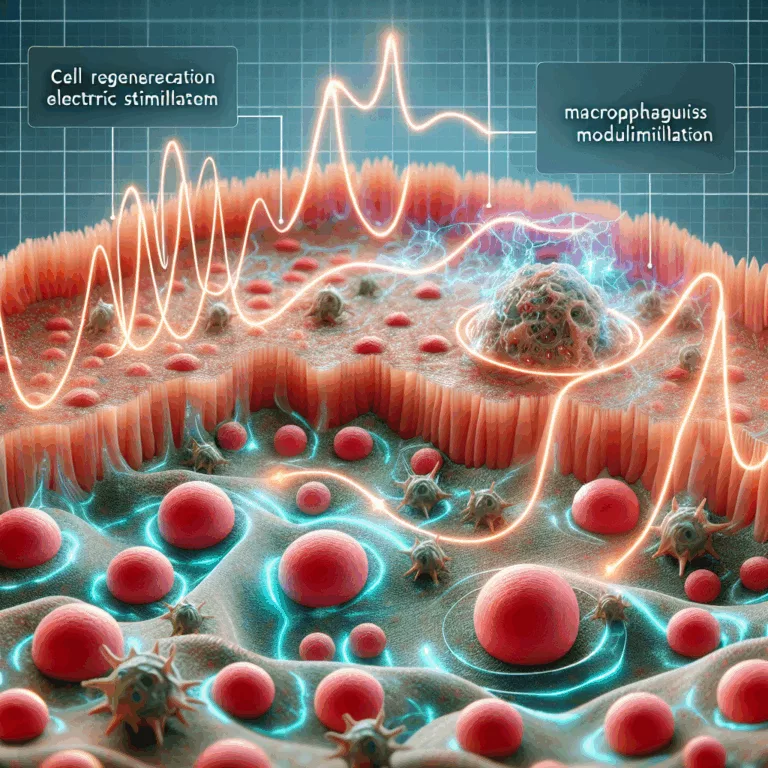
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
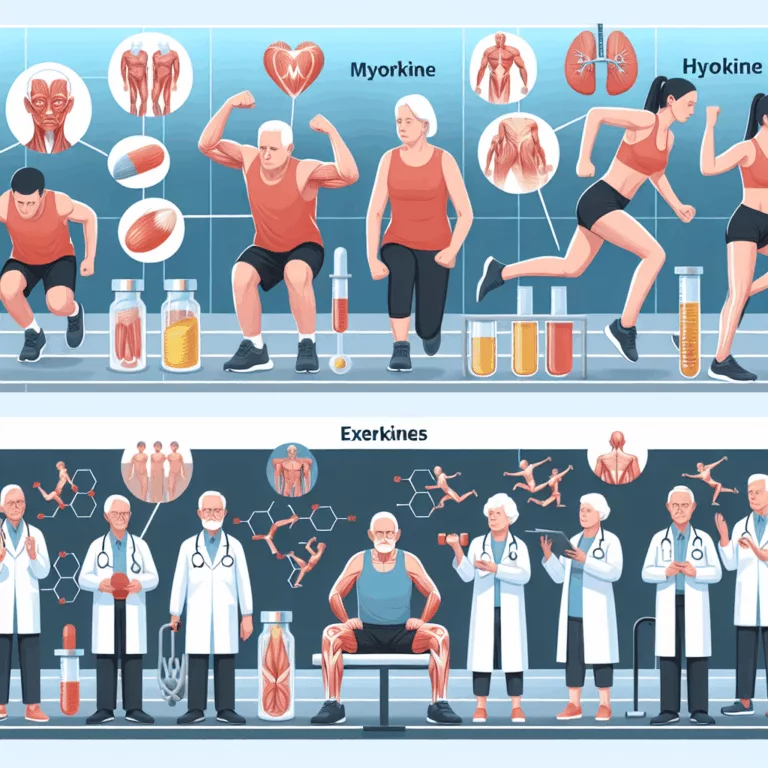
Le tissu musculaire est métaboliquement actif et joue un rôle essentiel dans la signalisation du corps. Les myokines sont des molécules signal produites par le tissu musculaire, tandis que les exerkines sont des molécules signal générées lors de l’exercice, qui induisent des améliorations fonctionnelles tant dans les muscles que dans d’autres organes. Bien que la…
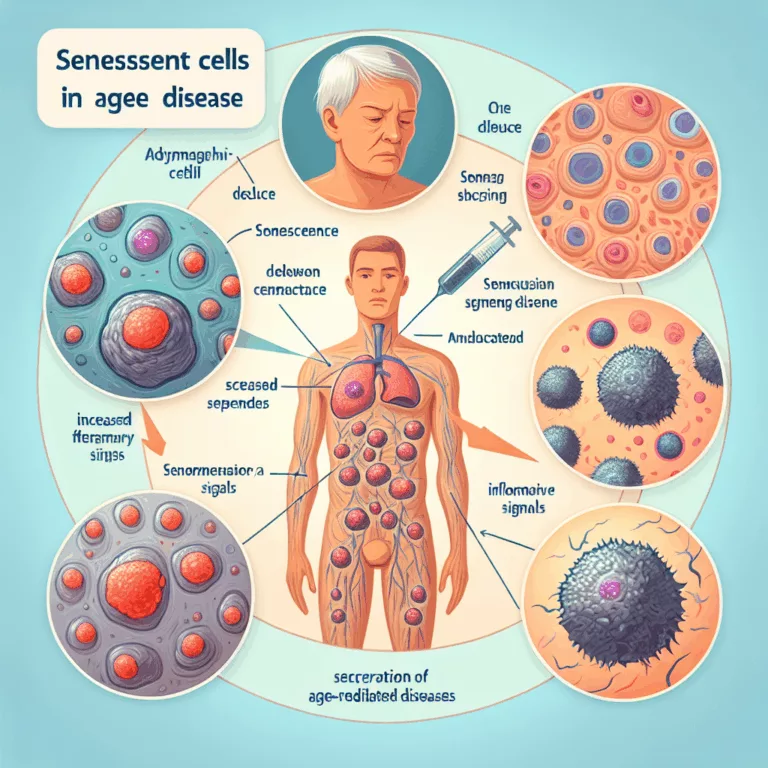
Le développement du cancer est fortement influencé par la présence de cellules sénescentes. La sénescence cellulaire agit comme un outil de suppression du cancer aux premiers stades de l’émergence des cancers, en essayant d’arrêter la réplication des cellules endommagées et en appelant le système immunitaire à détruire les cellules potentiellement cancéreuses via des signaux inflammatoires….
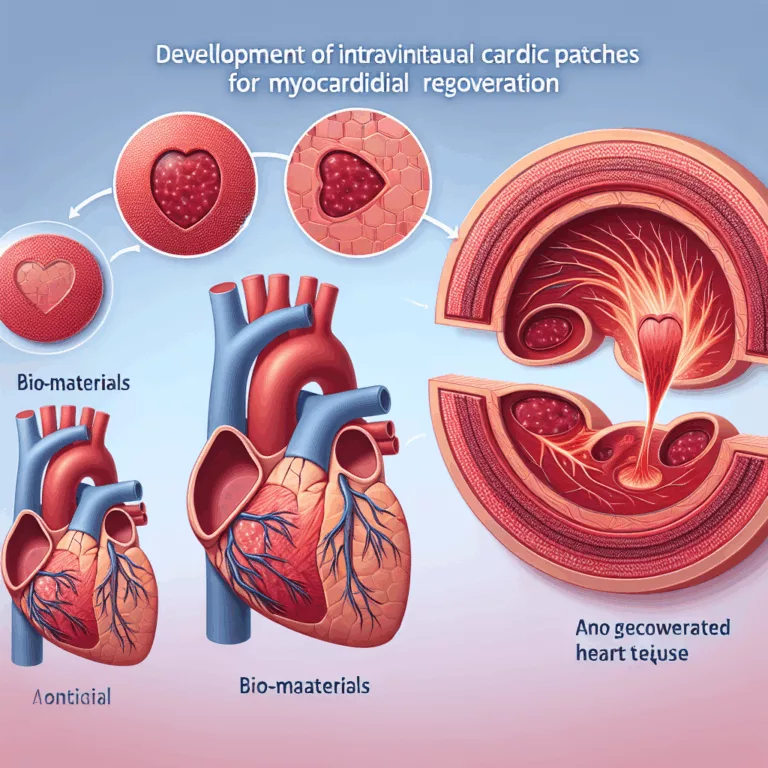
Le domaine de l’ingénierie tissulaire vise à produire des structures de tissus artificiels capables de soutenir des cellules et de s’intégrer au tissu natif lorsqu’elles sont implantées dans une lésion, favorisant ainsi la régénération qui n’aurait pas eu lieu autrement. À long terme, l’objectif est de créer des organes entièrement artificiels et fonctionnels. Cependant, la…

Fight Aging! est une plateforme qui traite de l’actualité et des commentaires en lien avec la lutte contre les maladies liées à l’âge, visant à maîtriser les mécanismes de vieillissement grâce à la médecine moderne. Le bulletin hebdomadaire est envoyé à des milliers d’abonnés intéressés par ces thématiques. Les services de consultation stratégique sont offerts…
Chaque cellule contient des centaines de mitochondries, qui sont les descendants de bactéries symbiotiques anciennes. Ces mitochondries ont leur propre ADN, se répliquent pour maintenir leur nombre et sont responsables de la production de l’adénosine triphosphate (ATP), la molécule qui stocke l’énergie chimique nécessaire au fonctionnement des cellules. Comme toutes les structures cellulaires, les mitochondries…

L’événement marquant de septembre à Irvine, Californie, est le premier Klotho Conference, qui rassemblera des chercheurs de premier plan, des cliniciens et des innovateurs biotechnologiques pour explorer le rôle de la protéine Klotho, liée à la longévité. Découverte en 1997, Klotho est associée à un vieillissement plus sain et est maintenant considérée comme une cible…

Le cartilage est un tissu à faible capacité de régénération, ce qui en fait une zone vulnérable au vieillissement et aux blessures articulaires. Malgré cela, le cartilage se forme durant le développement, ce qui indique qu’il existe des programmes de régénération qui pourraient être activés par des thérapies appropriées. Des chercheurs ont développé une approche…
Le vieillissement a un impact négatif sur la régénération musculaire pour des raisons qui ne sont pas complètement comprises. Cette incompréhension découle en partie du fait que la régénération musculaire implique un ensemble complexe d’interactions entre différents types de cellules, dont les comportements évoluent au fil du temps en réponse aux blessures. Il est bien…