Une avancée prometteuse dans la détection précoce de la maladie de Parkinson
CND Life Sciences reçoit un financement de 3 millions de dollars pour étudier le lien entre tremblement essentiel et risque de Parkinson.

CND Life Sciences reçoit un financement de 3 millions de dollars pour étudier le lien entre tremblement essentiel et risque de Parkinson.

Bexorg lève 42,5 millions de dollars pour optimiser son moteur d’IA basé sur des données cérébrales humaines, révolutionnant la découverte de médicaments.
Découvrez comment un gène du chromosome X influence l’inflammation et la sclérose en plaques, et comment la metformine peut inverser ces effets.
Une nouvelle étude publiée dans la revue Nature Aging a mis en évidence le rôle d’une protéine associée au fer, FTL1, dans le déclin cognitif lié à l’âge. Les chercheurs de l’UC San Francisco ont identifié FTL1 comme un facteur pro-vieillissement dans l’hippocampe, une région du cerveau cruciale pour l’apprentissage et la mémoire. Ils ont…
Les mitochondries sont des organites essentiels responsables de la production d’ATP, la molécule qui stocke l’énergie chimique nécessaire aux processus biochimiques. Considérées comme les descendants lointains de bactéries symbiotiques, chaque cellule humaine abrite des centaines de mitochondries. Avec l’âge, la fonction mitochondriale diminue pour diverses raisons complexes, notamment des dommages, des modifications de l’expression génique…

Aujourd’hui, deux entreprises biopharmaceutiques américaines, ProMIS Neurosciences et NKGen Biotech, ont annoncé des avancées significatives dans le développement de thérapies pour les maladies neurodégénératives, notamment la maladie d’Alzheimer. ProMIS a reçu une désignation Fast Track de la FDA pour son candidat thérapeutique principal, PMN310, un anticorps monoclonal conçu pour cibler spécifiquement les oligomères solubles d’amyloïde-bêta,…

La maladie des neurones moteurs (MND) est une pathologie dévastatrice, principalement représentée par la sclérose latérale amyotrophique (ALS), qui touche environ 90 % des personnes diagnostiquées. Cette maladie neurodégénérative progressive entraîne une dégradation des neurones moteurs, affectant la communication entre le cerveau et les muscles, ce qui entraîne une perte rapide de la fonction musculaire…

La psilocybine est un hallucinogène d’origine végétale qui a une longue histoire d’utilisation et une histoire plus récente de prohibition, ce qui a entravé les efforts de recherche sur sa biochimie. Cependant, ces dernières années, des efforts ont été déployés pour transformer la psilocybine, qui était auparavant prohibée, en une forme de thérapie pour des…
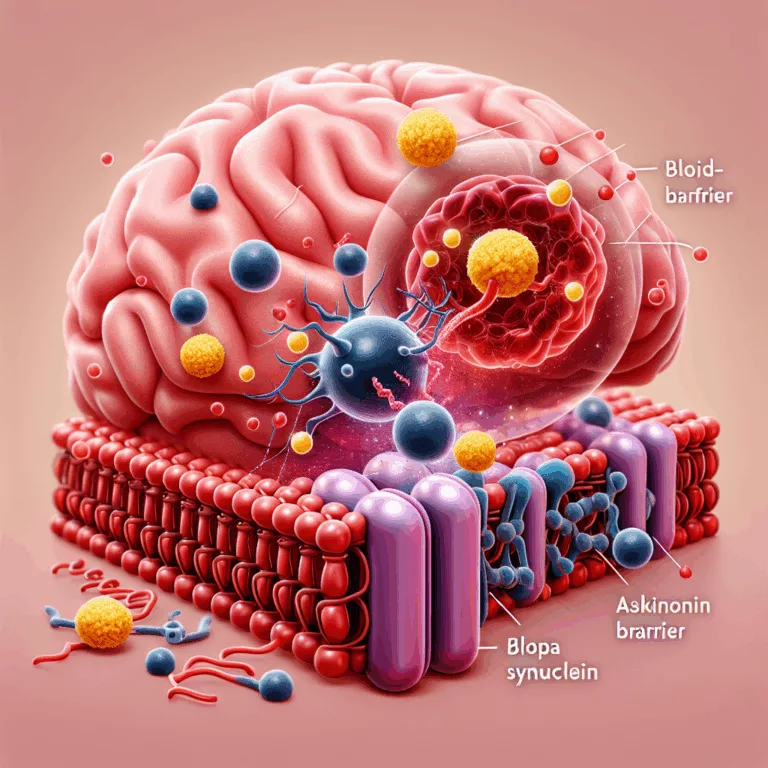
Les chercheurs ont découvert comment la protéine α-synucléine (α-syn), impliquée dans la maladie de Parkinson et la démence à corps de Lewy, entraîne une inflammation et une perturbation des axones dans le cerveau. Le cerveau est protégé par une barrière hémato-encéphalique (BHE) qui empêche de nombreuses substances dans le sang d’endommager les neurones. Les dommages…
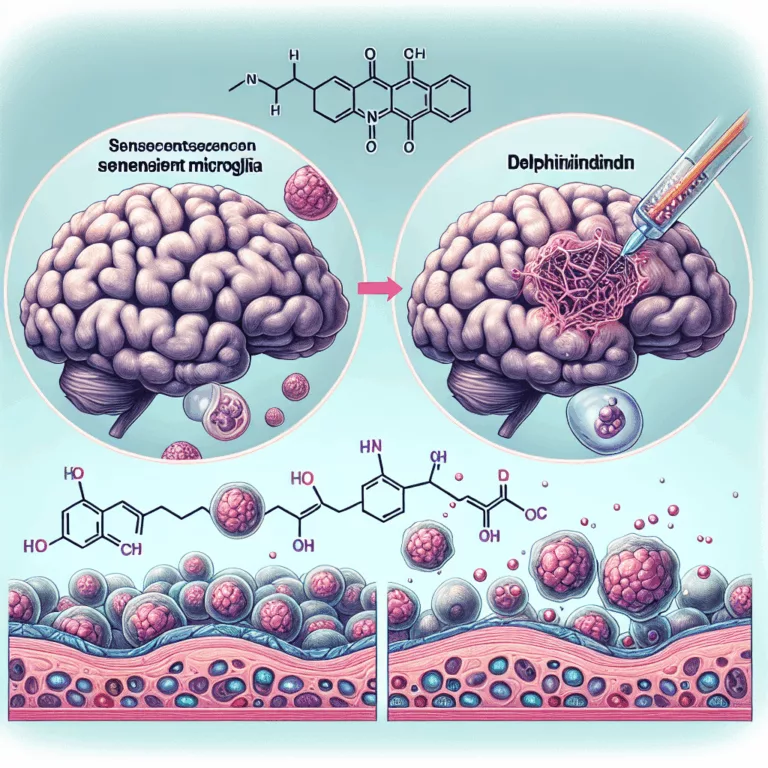
Les microglies sont des cellules immunitaires innées du cerveau, comparables aux macrophages dans le reste du corps. Des recherches récentes montrent que le comportement inflammatoire maladaptatif des microglies dans le cerveau vieillissant joue un rôle crucial dans l’apparition et la progression de maladies neurodégénératives comme la maladie d’Alzheimer. Certaines microglies deviennent inflammatoires en réponse à…