Vers une révolution thérapeutique : l’ingénierie des mitochondries pour lutter contre le vieillissement
Découvrez comment l’ingénierie des mitochondries pourrait transformer la médecine anti-âge en améliorant la fonction cellulaire.

Découvrez comment l’ingénierie des mitochondries pourrait transformer la médecine anti-âge en améliorant la fonction cellulaire.

Découvrez comment améliorer la fonction mitochondriale pourrait inverser le déclin lié à l’âge et favoriser une meilleure santé cellulaire.

Présentation de Cellvie Cellvie, une startup suisse de biotechnologie axée sur la longévité, a levé 5 millions de dollars pour faire avancer ses thérapies basées sur les mitochondries. Fondée en 2018 en tant que spinout de l’Université de Harvard, Cellvie développe des mitochondries provenant de lignées cellulaires humaines comme traitement pour des conditions liées à…
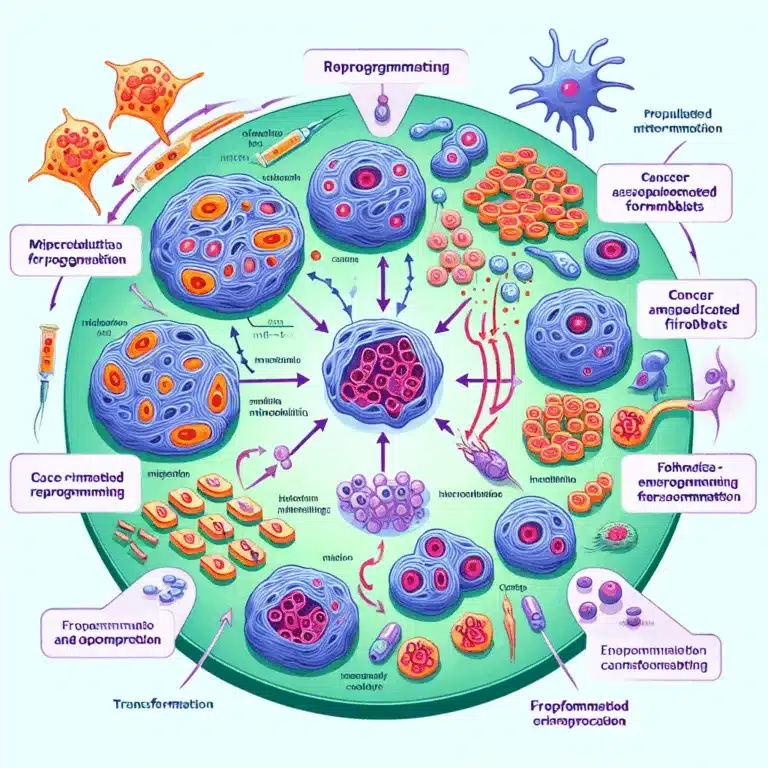
Les scientifiques ont découvert que les cellules cancéreuses recrutent des fibroblastes pour soutenir la croissance tumorale en leur transférant des mitochondries. Cette découverte ouvre de nouvelles pistes pour le traitement du cancer. En effet, les cellules cancéreuses ne fonctionnent pas seules ; leur succès repose souvent sur la coopération avec les cellules environnantes. Ces dernières…
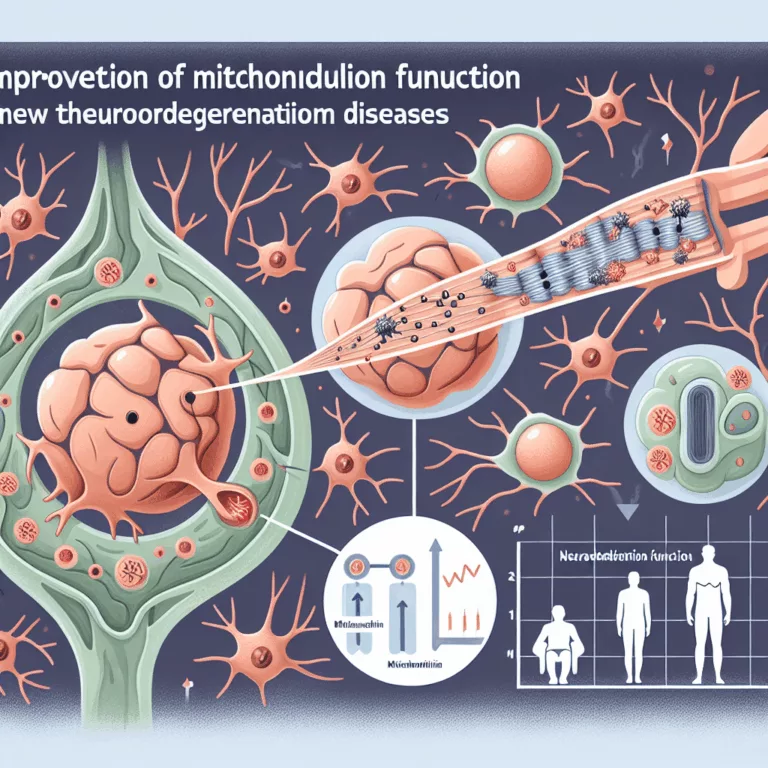
Les mitochondries sont des organites essentiels responsables de la production d’ATP, la molécule qui stocke l’énergie chimique nécessaire aux processus biochimiques. Considérées comme les descendants lointains de bactéries symbiotiques, chaque cellule humaine abrite des centaines de mitochondries. Avec l’âge, la fonction mitochondriale diminue pour diverses raisons complexes, notamment des dommages, des modifications de l’expression génique…
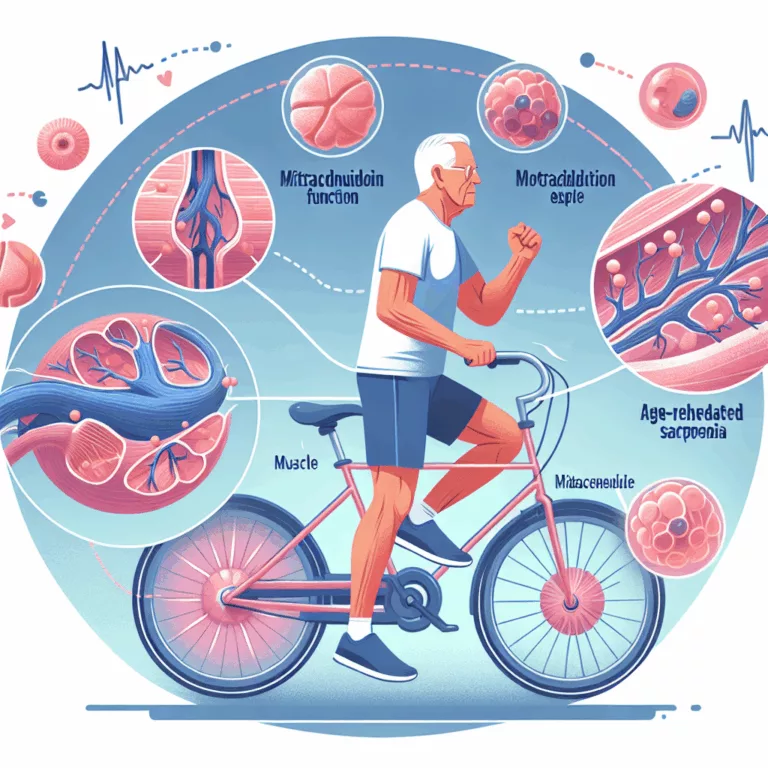
Les mitochondries, présentes en grand nombre dans chaque cellule, jouent un rôle crucial dans la production de l’ATP (adénosine triphosphate), la molécule d’énergie chimique qui alimente les processus cellulaires. La dysfonction mitochondriale est un phénomène typique du vieillissement et contribue de manière significative à la dégradation de la fonction tissulaire. Cette dysfonction est partiellement due…
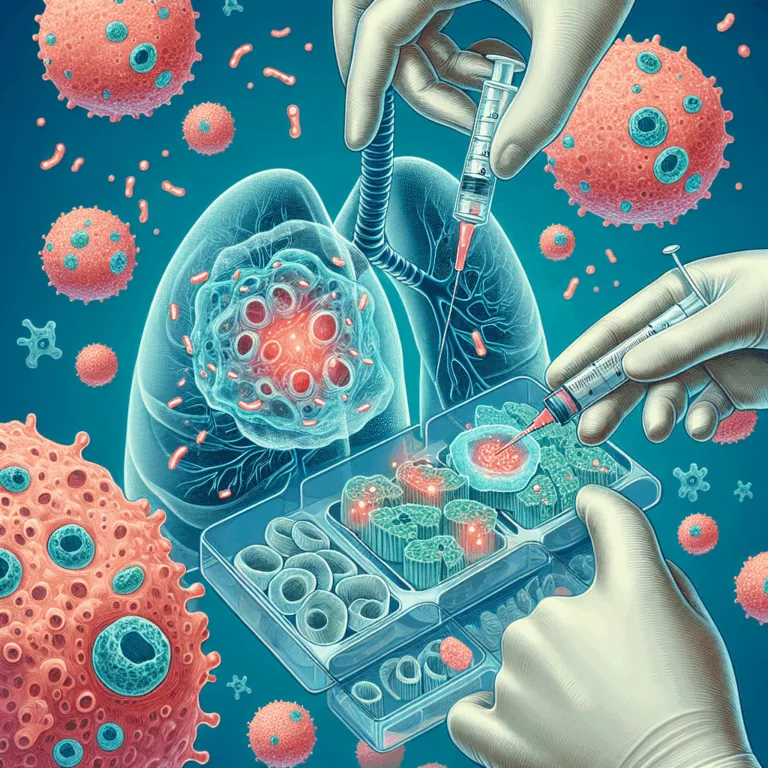
Les scientifiques ont démontré que l’injection de mitochondries saines, soit de façon systématique, soit directement dans le micro-environnement tumoral, augmente l’efficacité des thérapies anti-cancer standards. Bien que le cancer du poumon ne soit pas le plus répandu, il est la principale cause de mortalité liée au cancer. Le cancer du poumon non à petites cellules…
Chaque cellule contient des centaines de mitochondries, qui sont les descendants de bactéries symbiotiques anciennes. Ces mitochondries ont leur propre ADN, se répliquent pour maintenir leur nombre et sont responsables de la production de l’adénosine triphosphate (ATP), la molécule qui stocke l’énergie chimique nécessaire au fonctionnement des cellules. Comme toutes les structures cellulaires, les mitochondries…

Les mitochondries sont des organites essentiels présents dans chaque cellule, jouant un rôle crucial dans la production d’adénosine triphosphate (ATP), la principale source d’énergie chimique pour les cellules. Malheureusement, avec l’âge, les mitochondries deviennent dysfonctionnelles, contribuant ainsi à l’évolution du vieillissement dégénératif. Pour lutter contre ce phénomène, diverses approches sont explorées, parmi lesquelles la transplantation…

John G. Cramer, un professeur émérite de physique de 90 ans à l’Université de Washington, va devenir le premier humain à recevoir des mitochondries cultivées en bioreacteur dans le cadre d’une étude précoce sur la longévité dirigée par Mitrix Bio. Ce projet cherche à tester la transplantation mitochondriale pour le rajeunissement, attirant l’attention non seulement…