Adaptyx : Révolutionner le suivi de la santé grâce à un patch innovant
Découvrez comment Adaptyx transforme le suivi de la santé avec un patch portable pour la surveillance moléculaire continue.

Découvrez comment Adaptyx transforme le suivi de la santé avec un patch portable pour la surveillance moléculaire continue.
Découvrez comment le microbiome intestinal influence la santé et le vieillissement, et les innovations prometteuses dans ce domaine crucial.

Découvrez comment le canagliflozine influence le vieillissement cérébral et le potentiel de lutte contre la maladie d’Alzheimer chez les souris.

Des chercheurs révèlent que les lasers infrarouges améliorent le drainage lymphatique pour éliminer les toxines cérébrales chez les souris vieillissantes.
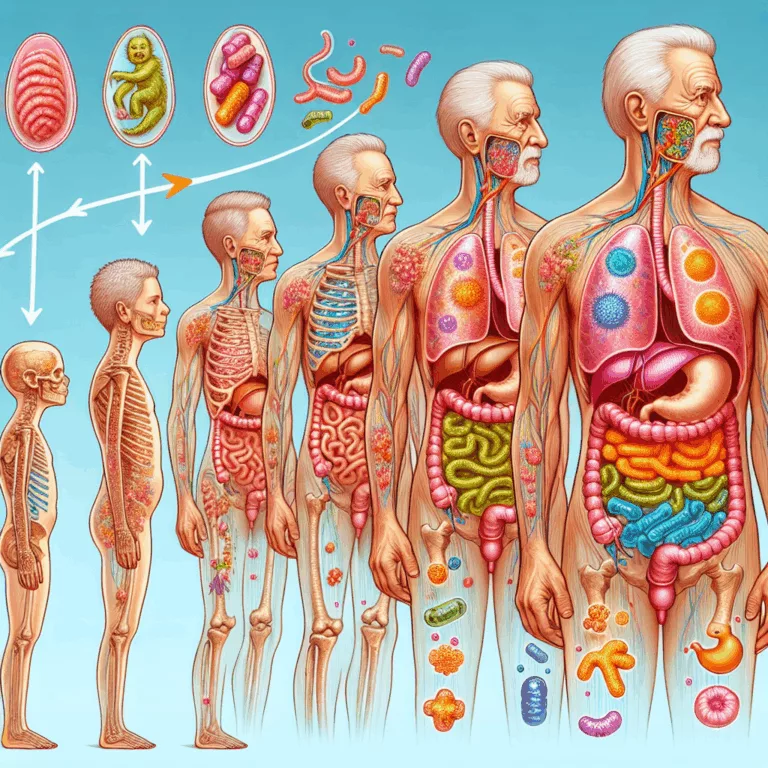
Le microbiome intestinal a suscité un grand intérêt ces dernières années, grâce à la possibilité d’évaluer de manière précise et économique sa composition par le séquençage de l’ARN ribosomal 16S. Les recherches montrent que la composition du microbiome intestinal évolue avec l’âge, favorisant des espèces générant une inflammation chronique au détriment de celles produisant des…
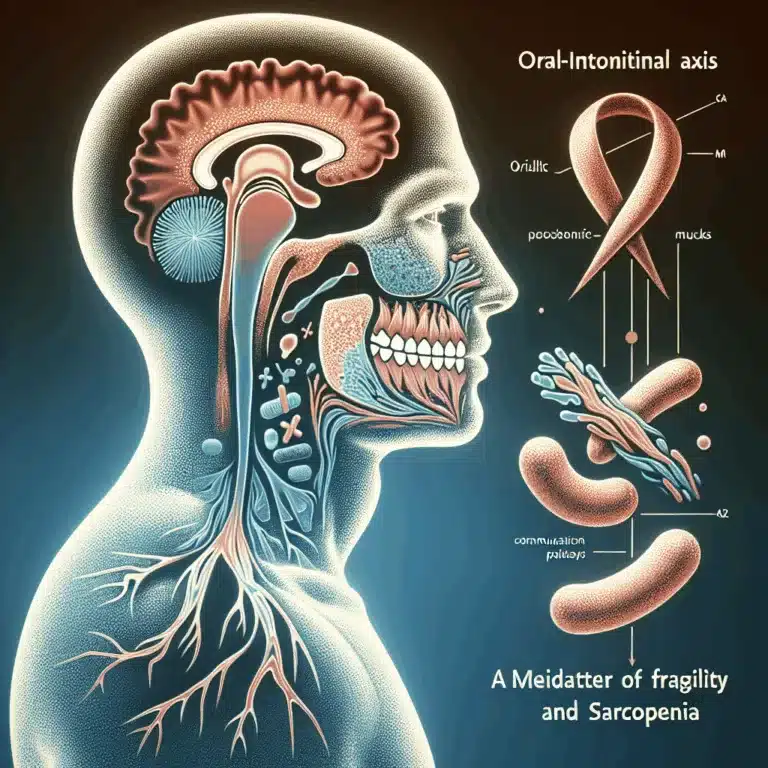
Ces dernières années, la recherche a mis en évidence l’influence de la composition du microbiome intestinal sur la santé à long terme ainsi que sur le vieillissement et les affections liées à l’âge. Des études ont établi des corrélations entre des espèces microbiennes spécifiques et des conditions de santé, montrant que l’ajustement de l’équilibre des…

Le site Fight Aging! se consacre à la publication de nouvelles et de commentaires sur l’objectif d’éradiquer les maladies liées à l’âge, en contrôlant les mécanismes du vieillissement grâce à la médecine moderne. Le bulletin hebdomadaire est envoyé à des milliers d’abonnés intéressés par ces thématiques. Le fondateur de Fight Aging!, Reason, propose également des…
La composition des populations microbiennes constituant le microbiome intestinal évolue avec l’âge. Les espèces inflammatoires et celles produisant des métabolites nocifs augmentent en nombre, au détriment des espèces générant des métabolites bénéfiques. Cela explique pourquoi les approches visant à rajeunir le microbiome intestinal, en le rétablissant dans un équilibre plus jeune, entraînent des gains significatifs…
La composition du microbiome intestinal évolue avec l’âge, et il a été démontré que certains microbes inflammatoires se multiplient au détriment des espèces bénéfiques qui produisent des métabolites tels que le butyrate. Les patients souffrant de maladies neurodégénératives, qui sont souvent marquées par une inflammation chronique et un dysfonctionnement immunitaire, présentent un microbiome intestinal dysfonctionnel….
Au cours des dernières années, de nombreuses études ont révélé que les patients atteints de la maladie d’Alzheimer présentent une composition distincte de leur microbiome intestinal par rapport à des pairs du même âge. Le microbiome intestinal évolue avec l’âge, perdant des microbes bénéfiques et leur production de métabolites nécessaires au fonctionnement des tissus, tout…