Identification de gènes centraux liés au vieillissement : Une étude sur C. elegans
Découvrez comment des gènes centraux identifiés chez C. elegans pourraient révolutionner notre compréhension du vieillissement et ses mécanismes complexes.
Découvrez comment des gènes centraux identifiés chez C. elegans pourraient révolutionner notre compréhension du vieillissement et ses mécanismes complexes.

Des chercheurs ont découvert que cultiver des cellules vieillissantes dans un milieu jeune les amène à se comporter et à fonctionner plus comme des cellules jeunes, ce qui suggère une nouvelle méthode pour créer des thérapies basées sur les cellules souches. Les cellules souches mésenchymateuses (CSM), capables de se différencier en plusieurs types cellulaires fonctionnels,…

Fight Aging! est un portail d’actualités et de commentaires qui se concentre sur l’objectif d’éliminer toutes les maladies liées à l’âge, en utilisant les mécanismes de vieillissement sous le contrôle de la médecine moderne. La newsletter hebdomadaire de Fight Aging! est envoyée à des milliers d’abonnés intéressés par la longévité. Reason, le fondateur de Fight…
La création de thérapies régénératives efficaces pour le cœur vieillissant est un domaine de recherche et de développement actif. Les thérapies cellulaires basées sur l’administration de cardiomyocytes se sont révélées difficiles, car la plupart des cellules transplantées ne survivent pas. Récemment, les chercheurs ont conçu des patchs tissulaires constitués de cardiomyocytes et de structures de…
La matrice extracellulaire (MEC) est une structure complexe de molécules produites et maintenues par les cellules pour se soutenir et déterminer les propriétés physiques d’un tissu, comme sa capacité à supporter des charges ou son élasticité. Les changements de la MEC avec l’âge, bien que peu explorés, nuisent aux cellules et à la fonction tissulaire….
Un nombre croissant de travaux suggère que l’accumulation de cellules sénescentes contribue à la dégénérescence fonctionnelle et structurelle des disques intervertébraux (DIV) dans la colonne vertébrale. Ce phénomène est particulièrement préoccupant, car il est à l’origine de douleurs et de pertes fonctionnelles. La capacité de restaurer ces fonctions perdues est très limitée, mais l’élimination des…
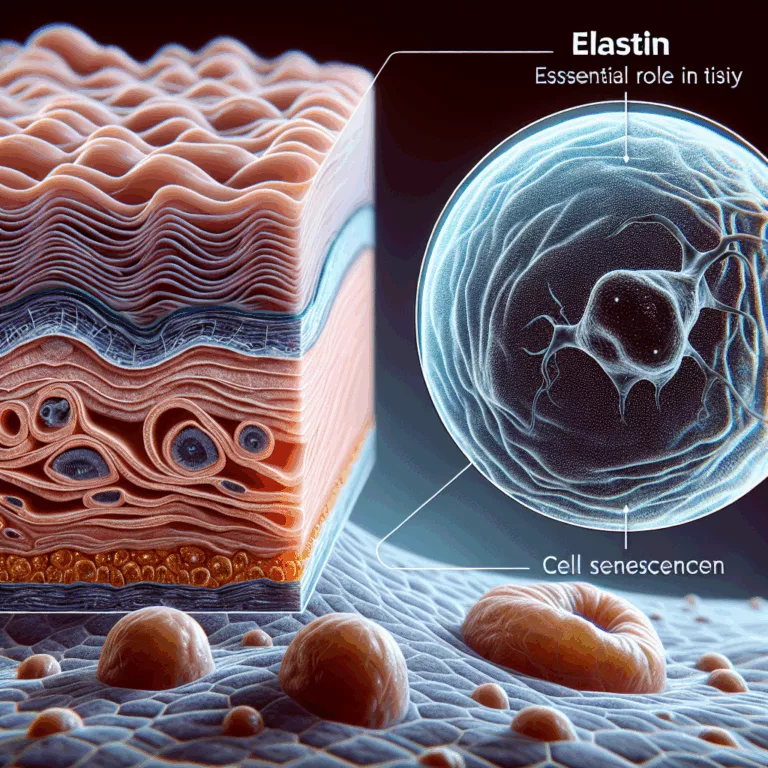
L’élastine est un composant essentiel de la matrice extracellulaire dans les tissus flexibles, nécessaire à l’élasticité des tissus. Avec l’âge, les fibres d’élastine subissent des dommages, modifiant non seulement les propriétés structurelles des tissus, mais affectant également le comportement cellulaire de manière négative. La fragmentation de l’élastine peut conduire à des inflammations et d’autres réponses…

Le reprogrammation cellulaire complète se produit dans les premiers stades de l’embryon, entraînée par l’expression des facteurs de Yamanaka, souvent abrégés en OSKM. Ce processus transforme les cellules germinales adultes en cellules souches embryonnaires, réinitialisant les motifs épigénétiques et restaurant la fonction mitochondriale. Les chercheurs ont réussi à reproduire ce processus pour produire des cellules…
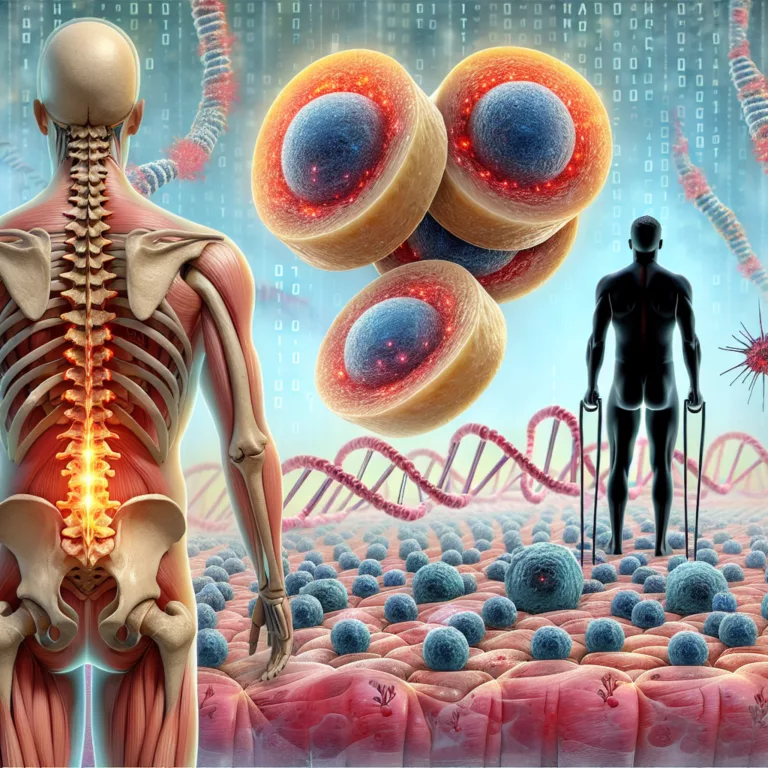
Une nouvelle étude publiée dans le journal Nature, intitulée Bone Research, a révélé que la reprogrammation épigénétique des cellules du disque spinal réduit la sénescence et soulage la douleur dans un modèle animal. Les cellules du noyau pulpeux, qui maintiennent les disques de la colonne vertébrale, se détériorent avec l’âge, perdant leur capacité de renouvellement…
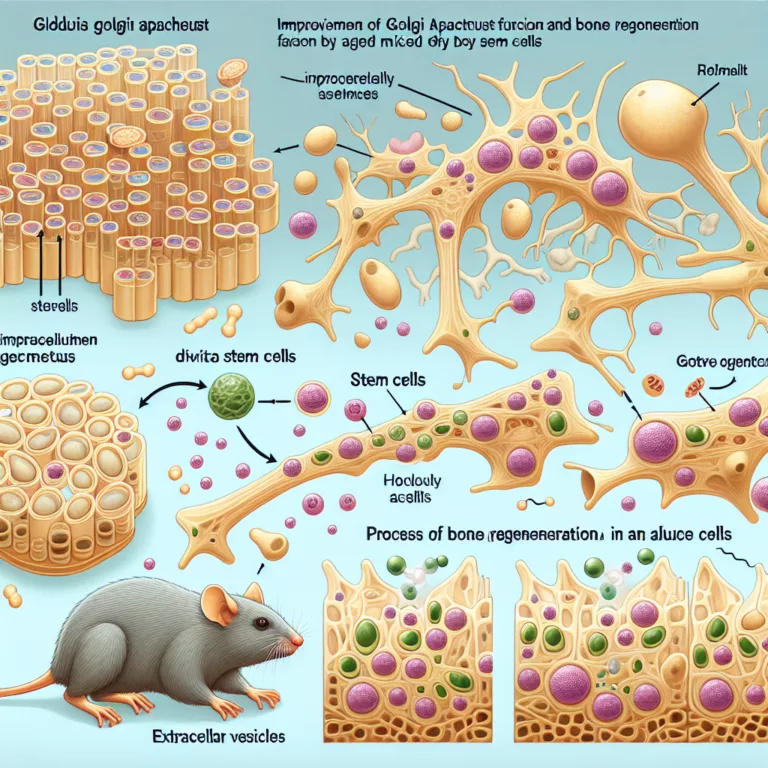
L’appareil de Golgi, bien qu’il soit souvent négligé dans les discussions sur le vieillissement, subit des dysfonctionnements comme toutes les structures cellulaires. Il joue un rôle crucial dans la direction des protéines nouvellement fabriquées vers leur destination, que ce soit à l’intérieur de la cellule ou pour être sécrétées dans des vésicules extracellulaires. Des chercheurs…