Révolution dans la compréhension du vieillissement : la glycation comme cible thérapeutique
Découvrez comment la réduction de la glycation pourrait prolonger la durée de vie et améliorer la santé métabolique, selon des recherches prometteuses.

Découvrez comment la réduction de la glycation pourrait prolonger la durée de vie et améliorer la santé métabolique, selon des recherches prometteuses.
La protéine STING (Stimulateur des gènes de l’interféron) joue un rôle central dans la détection des dommages cellulaires et des infections, en initiant une réponse inflammatoire. Cependant, les dysfonctionnements cellulaires liés au vieillissement, tels que l’évasion de fragments d’ADN mitochondrial et nucléaire dans le cytosol, activent les capteurs biologiques conçus pour détecter des agents infectieux,…
Ces dernières années, l’inhibition de la signalisation de mTOR a suscité un intérêt considérable en tant que mécanisme pour réguler l’autophagie (optimiser l’autophagie par le jeûne), une stratégie mimétique de restriction calorique pour le développement de médicaments. Bien qu’il existe plusieurs molécules petites, sûres et peu coûteuses qui atteignent cet objectif, la rapamycine étant la…

Yuva Biosciences, une entreprise biotech spécialisée dans la longévité, a signé un accord de développement et de licence avec Northstrive Biosciences pour faire avancer des thérapies pharmaceutiques ciblant la dysfonction mitochondriale, qui est liée à des conditions métaboliques telles que l’obésité et le diabète de type 2. Cet accord permet à YuvaBio de recevoir des…
Les mitochondries sont des organites essentiels, souvent décrites comme les centrales énergétiques de la cellule, car elles produisent l’adénosine triphosphate (ATP), la molécule qui stocke l’énergie chimique nécessaire aux processus biochimiques cellulaires. Cependant, la fonction mitochondriale diminue avec l’âge, en partie à cause des dommages à l’ADN mitochondrial et des changements dans l’expression génique nucléaire…

La communauté de recherche accumule progressivement des données sur la relation entre les horloges biologiques du vieillissement et l’évaluation de l’âge biologique ainsi que les mesures existantes de maladies et de dysfonctionnements. Par exemple, l’indice cardiométabolique (ICM) est une mesure combinée d’obésité et de dysfonctionnement du métabolisme lipidique, associé aux maladies métaboliques liées à l’âge…
Une nouvelle étude révèle que les mitochondries endommagées activent la réponse au stress intégrée, ce qui entraîne une perte d’identité et un dysfonctionnement des cellules β pancréatiques, ainsi que des cellules hépatiques et adipeuses. En bloquant cette réponse, des bénéfices ont été observés dans des modèles murins. Le lien entre mitochondries et diabète de type…
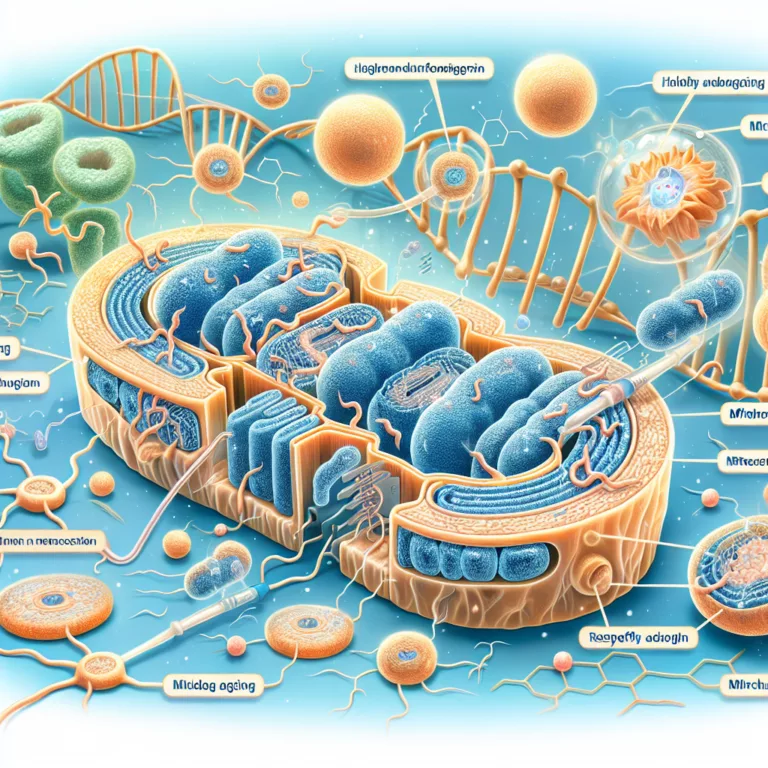
Les mitochondries sont souvent considérées comme les centrales énergétiques des cellules, car elles produisent la molécule d’énergie chimique, l’adénosine triphosphate (ATP). Chaque cellule humaine possède des centaines de mitochondries, qui ont évolué à partir de bactéries symbiotiques ayant pris résidence dans les ancêtres des eucaryotes modernes. Ces organites se reproduisent de manière similaire aux bactéries…

Maze Therapeutics est une entreprise de médecine de précision basée à San Francisco, qui a récemment déposé une demande d’introduction en bourse (IPO) auprès de la Securities and Exchange Commission. Fondée en 2017, la société se concentre sur le développement de médicaments de précision sous forme de petites molécules, ciblant principalement les maladies rénales, cardiovasculaires…

Amylyx Pharmaceuticals, une biopharmaceutique américaine, a récemment formé un partenariat avec Gubra, une biotech danoise, pour développer un nouvel antagoniste du récepteur GLP-1 à action prolongée. Cette collaboration intervient après le retrait du traitement approuvé par la FDA pour la SLA d’Amylyx, qui a été motivé par des données cliniques indiquant un manque d’efficacité. La…