Les Mystères des Cellules en Microgravité : Une Révolution Scientifique en Cours
Découvrez comment la microgravité influence la recherche sur les cellules souches et ses implications pour la médecine moderne.

Découvrez comment la microgravité influence la recherche sur les cellules souches et ses implications pour la médecine moderne.
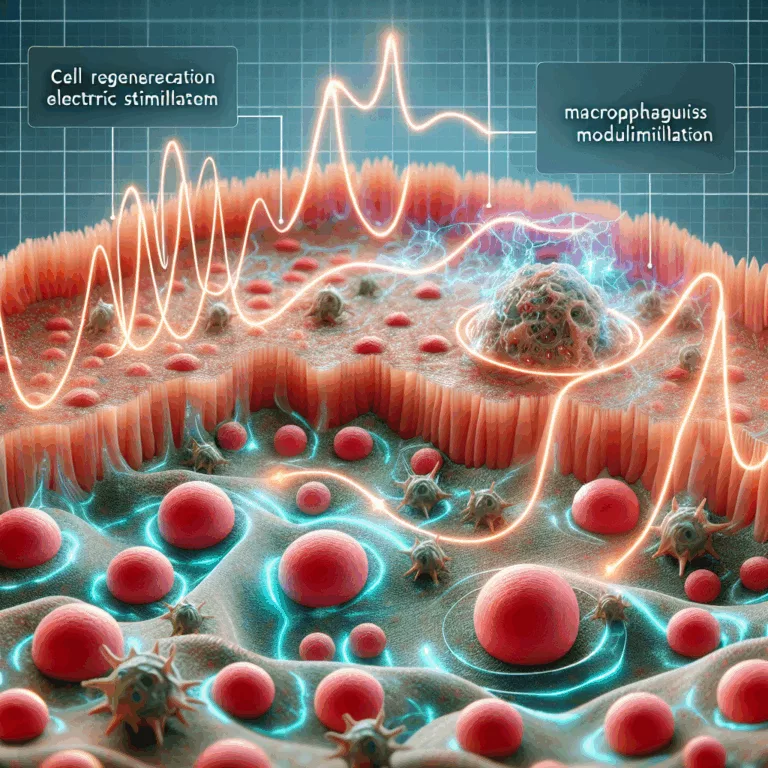
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.

Une étude récente publiée dans le Journal of Pharmacology and Experimental Therapeutics présente une stratégie thérapeutique innovante visant à réparer les dommages tissulaires causés par des maladies inflammatoires chroniques et dégénératives, notamment l’arthrite rhumatoïde (RA) et la fibrose, grâce à l’inhibition du complexe I mitochondrial. Conduite par la société Istesso, spécialisée dans la réparation tissulaire,…

Pretzel Therapeutics, une entreprise de biotechnologie américaine basée dans le Massachusetts, se concentre sur le développement de traitements pour les maladies mitochondriales, en particulier celles associées aux mutations du gène POLG et aux syndromes de déplétion de l’ADN mitochondrial (ADNmt). Récemment, elle a obtenu un investissement de The Mito Fund, une initiative philanthropique de capital-risque…

Sironax, une entreprise de biotechnologie spécialisée dans le domaine de la longévité, a récemment annoncé un accord stratégique avec le géant pharmaceutique Novartis. Cet accord confère à Novartis une option exclusive d’acquérir la plateforme propriétaire de Sironax, conçue pour améliorer la livraison de traitements au travers de la barrière hémato-encéphalique (BHE). Cette étape permettra à…
Les chercheurs ont exploré les effets bénéfiques du sulfure d’hydrogène (H2S) sur le métabolisme cellulaire dans le contexte du vieillissement. Une présence accrue de H2S semble améliorer modérément la fonction mitochondriale et l’autophagie, réduisant ainsi le stress oxydatif et l’inflammation associés au vieillissement. Ce processus se fait par une modification post-traductionnelle des protéines importantes via…
Les problèmes de dos chez les personnes âgées sont largement reconnus comme étant causés par une détérioration de la colonne vertébrale, notamment la dégénérescence des disques intervertébraux (IDD). Cette affection rend les disques moins élastiques, diminuant leur capacité à supporter des charges et à maintenir la colonne vertébrale. Les chercheurs ont découvert que la sénescence…
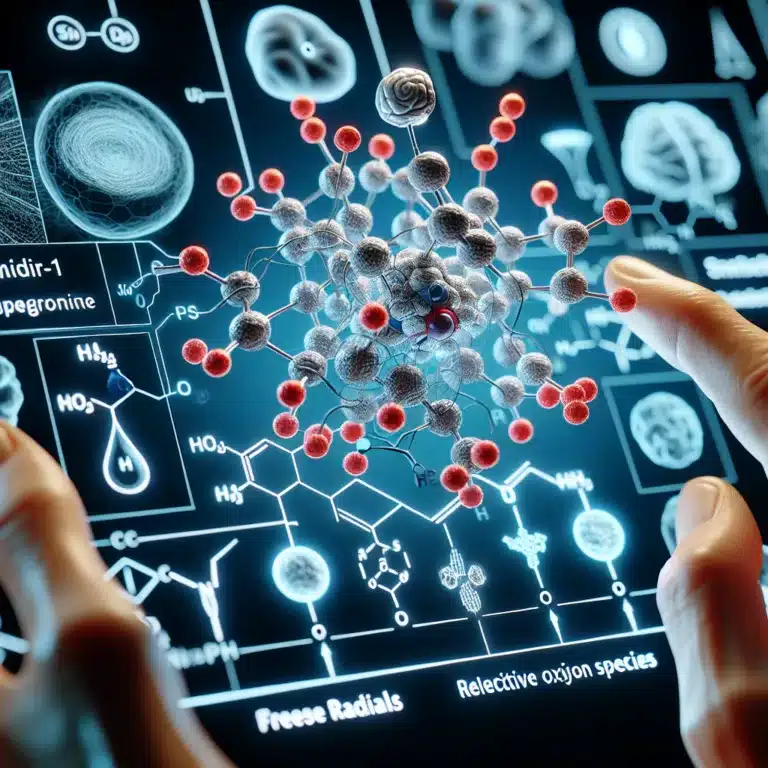
Telomir Pharmaceuticals a récemment présenté des résultats prometteurs issus des essais précliniques de son composé de petite molécule, Telomir-1, qui démontre la capacité de ce dernier à inverser complètement le stress oxydatif induit par le cuivre dans des lignées cellulaires humaines et à fournir une protection significative contre la toxicité cellulaire. Ce développement pourrait avoir…