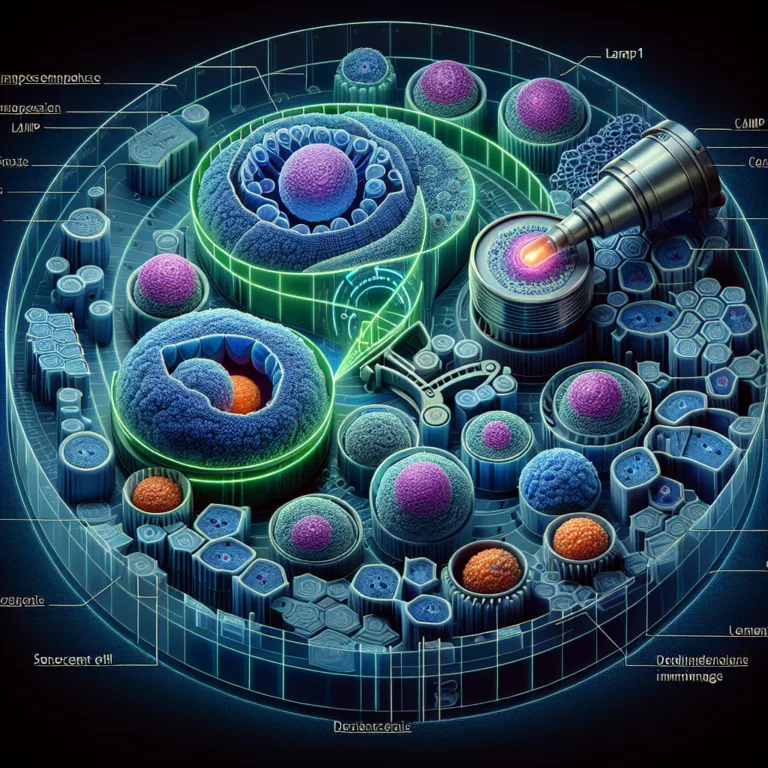
Identification et ciblage des cellules sénescentes par le marqueur LAMP1
Les cellules sénescentes, qui accumulent avec l’âge, présentent des caractéristiques distinctives, notamment une augmentation de leur contenu lysosomal, ce qui les rend essentielles à la compréhension du vieillissement et au développement d’interventions ciblées. Les protéines spécifiques à la surface des cellules sénescentes peuvent servir de base pour des immunothérapies visant à détruire ces cellules. Des…