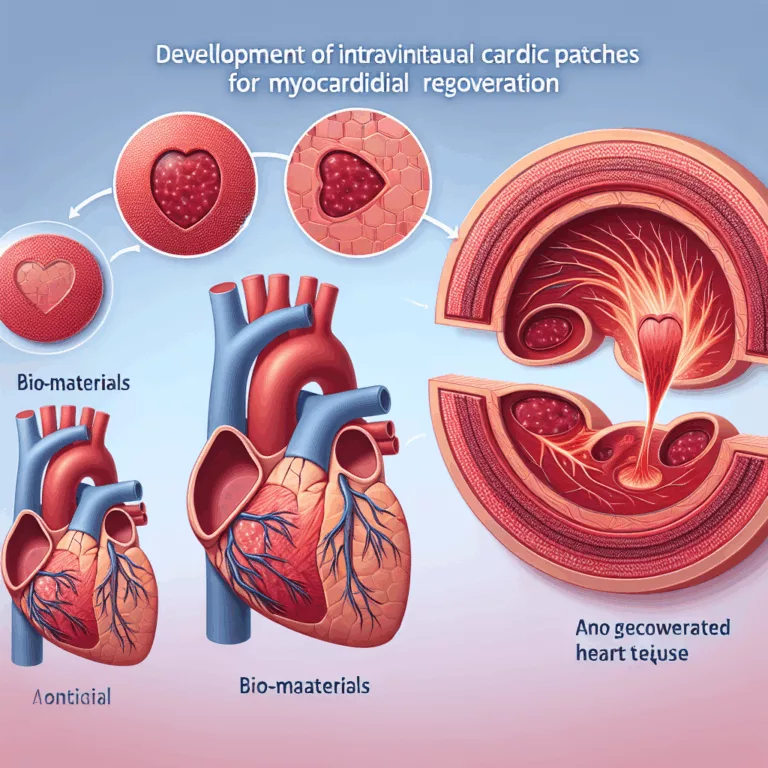
Développement de patchs cardiaques intraventriculaires pour la régénération myocardique
Le domaine de l’ingénierie tissulaire vise à produire des structures de tissus artificiels capables de soutenir des cellules et de s’intégrer au tissu natif lorsqu’elles sont implantées dans une lésion, favorisant ainsi la régénération qui n’aurait pas eu lieu autrement. À long terme, l’objectif est de créer des organes entièrement artificiels et fonctionnels. Cependant, la…