La sénescence cellulaire et son impact sur la santé cardiovasculaire : enjeux et perspectives
Découvrez comment la sénescence cellulaire influence les maladies cardiovasculaires et explorez des approches thérapeutiques innovantes.
Découvrez comment la sénescence cellulaire influence les maladies cardiovasculaires et explorez des approches thérapeutiques innovantes.
La maladie hépatique associée à la dysfonction métabolique (MASH) est une affection qui survient après une stéatose hépatique, principalement causée par l’obésité et aggravée par le vieillissement. Cette condition entraîne une dysfonction du tissu hépatique, ce qui se traduit par un fardeau croissant de fibrose et une perte de fonction hépatique. Dans la fibrose, les…

Une étude récente publiée dans le Journal of Pharmacology and Experimental Therapeutics présente une stratégie thérapeutique innovante visant à réparer les dommages tissulaires causés par des maladies inflammatoires chroniques et dégénératives, notamment l’arthrite rhumatoïde (RA) et la fibrose, grâce à l’inhibition du complexe I mitochondrial. Conduite par la société Istesso, spécialisée dans la réparation tissulaire,…
Dans un article publié dans la revue *Molecular Therapy*, des chercheurs ont rapporté la création de cellules exprimant le facteur régénératif GDF11, qui se sont révélées améliorer la fibrose dans un modèle murin. GDF11, tout comme d’autres facteurs, a suscité un intérêt considérable dans le cadre des maladies liées à l’âge. Cependant, les recherches sur…
La recherche scientifique sur les maladies liées à l’âge se concentre souvent sur l’étude de protéines spécifiques, dont la biologie et les interactions sont relativement bien comprises. Cela implique une attention fluctuante portée sur certaines protéines selon l’intérêt de la communauté scientifique. Les chercheurs modifient leurs priorités pour approfondir leur compréhension et explorer les moyens…
Calico Life Sciences, une entreprise de biotechnologie d’Alphabet axée sur le vieillissement et les maladies liées à l’âge, a conclu un accord de licence exclusif avec Mabwell Bioscience, une société biotechnologique basée à Shanghai, pour le développement et la commercialisation de thérapeutiques ciblant l’interleukine-11 (IL-11). Cet accord, d’une valeur initiale de 25 millions de dollars,…

HAYA Therapeutics, une start-up de biotechnologie spécialisée dans la médecine de précision, a récemment levé 65 millions de dollars lors d’un financement de série A pour faire avancer le développement de médicaments guidés par l’ARN, ciblant les maladies chroniques et liées à l’âge en modulant le génome régulateur. Ce financement permettra à l’entreprise d’accélérer les…

Les cellules sénescentes s’accumulent avec l’âge dans les tissus du corps. Elles sont produites tout au long de la vie, principalement parce que les cellules somatiques atteignent la limite de Hayflick lors de leur réplication, mais aussi à cause de divers stress. Dans la jeunesse, les cellules sénescentes nouvellement créées sont rapidement éliminées par le…
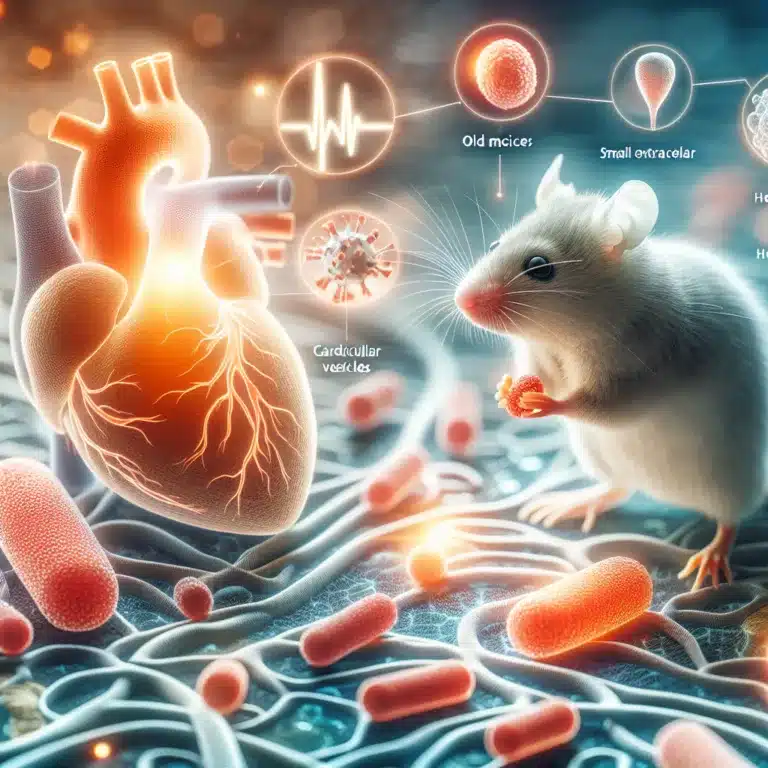
Dans une étude publiée dans la revue *Stem Cell Research & Therapy*, des chercheurs ont découvert que les petites vésicules extracellulaires (sEVs) provenant de souris jeunes peuvent atténuer les dysfonctionnements cardiaques chez les souris âgées. Les vésicules extracellulaires ont été classées selon leur origine, mais la séparation actuelle repose principalement sur leur taille, avec une…

Tribune Therapeutics, une biotech scandinave, a levé 37 millions d’euros pour faire avancer son portefeuille de thérapies anti-fibrotiques de nouvelle génération. Ces fonds serviront à développer cliniquement le candidat principal de l’entreprise, un mimétique de CCN5, conçu pour lutter contre la fibrose à ses causes profondes. La fibrose est caractérisée par une accumulation excessive de…