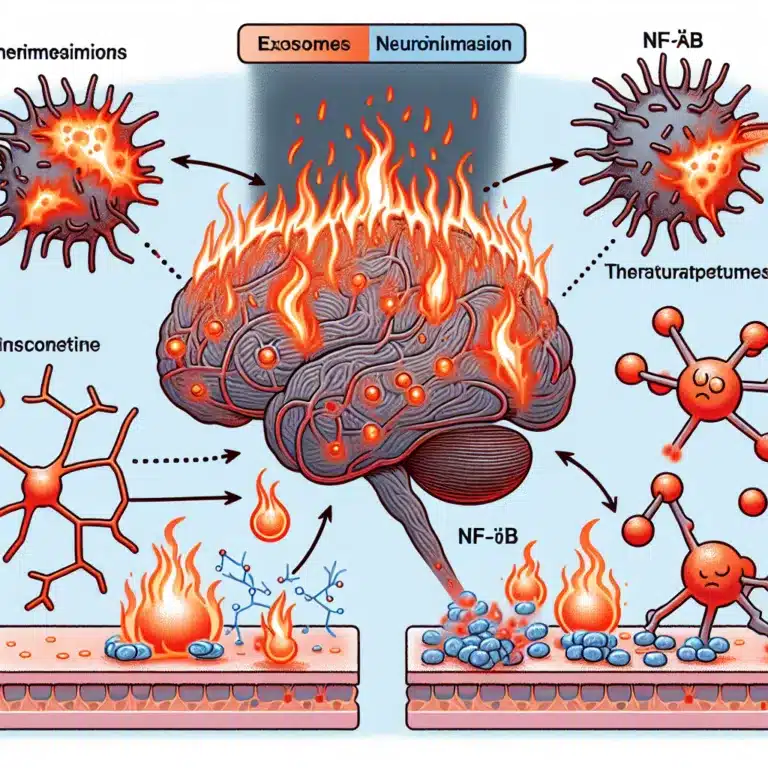
Exosomes et NF-κB : Une approche prometteuse pour traiter la neuroinflammation liée à l’âge
Le NF-κB est un facteur de transcription crucial dans la signalisation inflammatoire, jouant un rôle central dans la régulation des réponses inflammatoires. Bien que la suppression de l’inflammation chronique soit un objectif de recherche important, il existe des défis considérables à surmonter. En effet, les voies de signalisation utilisées lors des réponses inflammatoires normales et…