Elamipretide : Première thérapie approuvée pour le syndrome de Barth
Découvrez l’Elamipretide, la première thérapie approuvée pour le syndrome de Barth, et son potentiel révolutionnaire pour améliorer la fonction mitochondriale.

Découvrez l’Elamipretide, la première thérapie approuvée pour le syndrome de Barth, et son potentiel révolutionnaire pour améliorer la fonction mitochondriale.
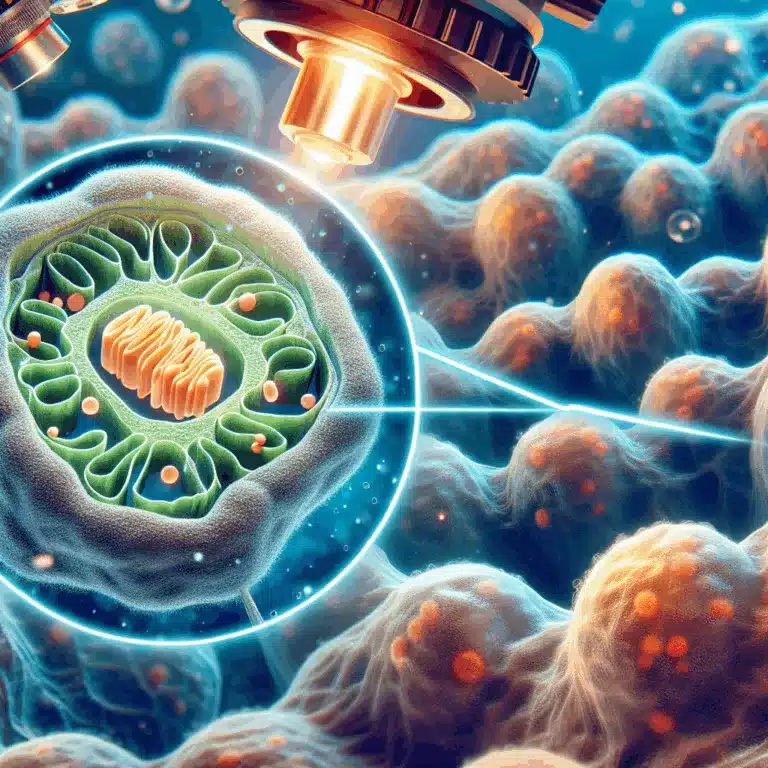
L’approbation de Forzinity par la FDA révolutionne la médecine mitochondriale, promettant des avancées majeures pour la longévité et le traitement des maladies liées à l’âge.

Découvrez comment la perte de coordination de l’expression génique pourrait révéler les mécanismes secrets du vieillissement biologique.

NRG Therapeutics lève 67 millions de dollars pour développer des thérapies ciblant la dysfonction mitochondriale dans les maladies neurodégénératives. Découvrez leur approche innovante !
La société biopharmaceutique israélienne Minovia Therapeutics a récemment reçu une subvention de 350 000 dollars de la fondation Countdown for a Cure pour faire avancer le développement de biomarqueurs sanguins liés à la santé mitochondriale. Cette somme financera des essais en cours au Sheba Medical Center, où des échantillons de sang seront collectés à la…

L’inflammaging est un phénomène lié à l’âge, caractérisé par une tendance du système immunitaire à entrer dans un état d’inflammation chronique sans provocations externes, comme les blessures ou les infections. Les recherches ont mis en évidence divers mécanismes contribuant à ce phénomène, notamment l’accumulation de cellules sénescentes qui produisent des signaux pro-inflammatoires, l’excès de tissu…
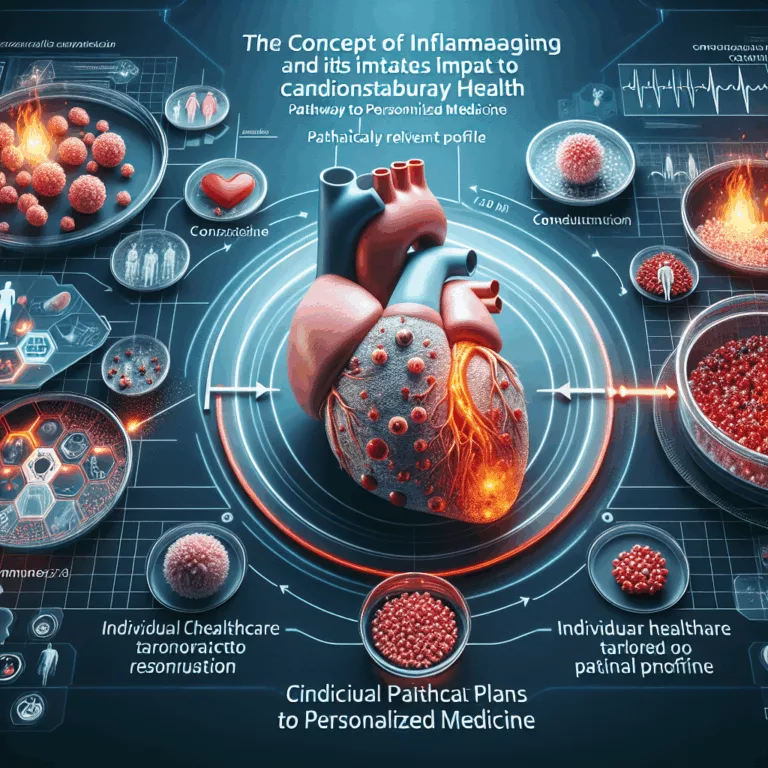
Dans la revue Cell Reports Medicine, des chercheurs examinent en détail la relation entre les maladies cardiovasculaires et une inflammation liée à l’âge, connue sous le nom d’inflammaging. Ce phénomène est caractérisé par une inflammation systémique difficile à détecter qui s’intensifie avec l’âge. L’inflammaging affecte non seulement le système immunitaire, mais également le cœur. Les…
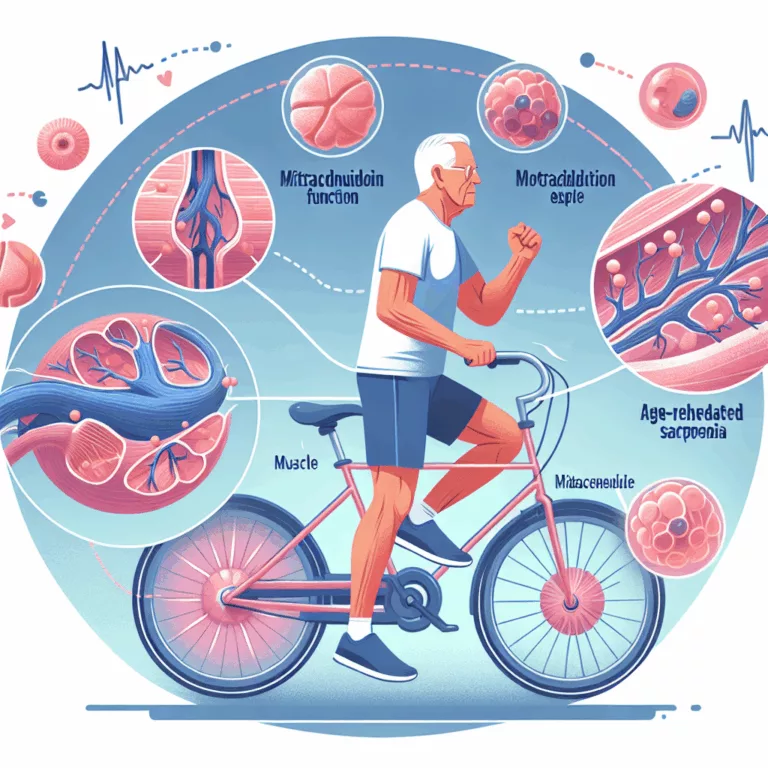
Les mitochondries, présentes en grand nombre dans chaque cellule, jouent un rôle crucial dans la production de l’ATP (adénosine triphosphate), la molécule d’énergie chimique qui alimente les processus cellulaires. La dysfonction mitochondriale est un phénomène typique du vieillissement et contribue de manière significative à la dégradation de la fonction tissulaire. Cette dysfonction est partiellement due…
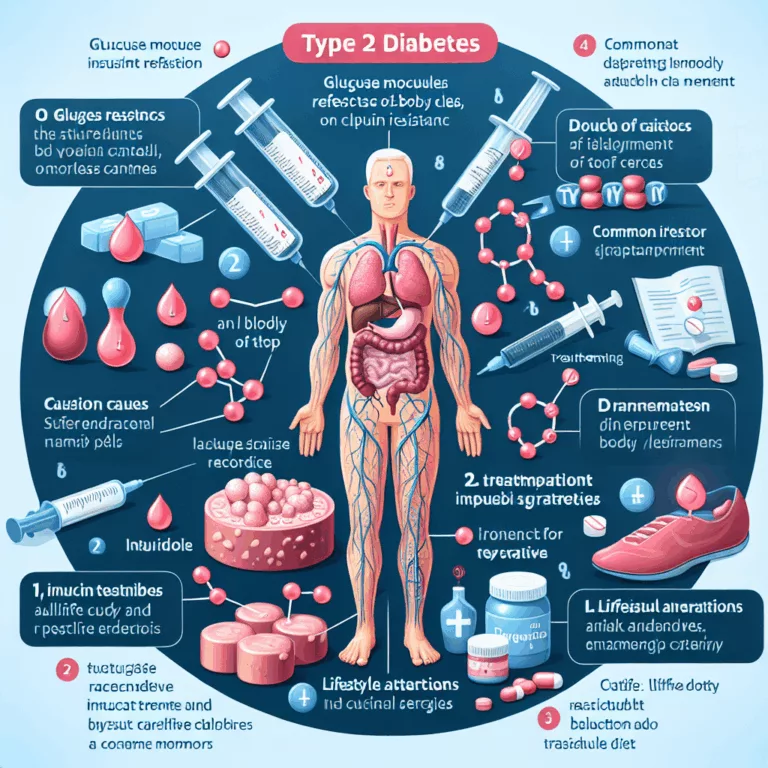
Le diabète de type 2 (T2D) est un trouble métabolique qui se caractérise par la résistance à l’insuline, l’inflammation et une régulation altérée du métabolisme du glucose. Ce phénomène se propage à l’échelle mondiale, en partie à cause du vieillissement, qui peut endommager le système immunitaire et accélérer la progression de ce trouble métabolique. Une…

Fight Aging! est une plateforme qui publie des nouvelles et des commentaires sur les avancées visant à éliminer les maladies liées à l’âge, en utilisant les mécanismes du vieillissement sous le contrôle de la médecine moderne. Le site propose une newsletter hebdomadaire envoyée à des milliers d’abonnés. L’industrie de la longévité est en pleine expansion,…