L’impact du microbiome intestinal sur le vieillissement et la santé : Une exploration essentielle
Découvrez comment le microbiome intestinal influence la santé et le vieillissement, et les innovations prometteuses dans ce domaine crucial.
Découvrez comment le microbiome intestinal influence la santé et le vieillissement, et les innovations prometteuses dans ce domaine crucial.
Le microbiome intestinal a suscité un grand intérêt ces dernières années, grâce à la possibilité d’évaluer de manière précise et économique sa composition par le séquençage de l’ARN ribosomal 16S. Les recherches montrent que la composition du microbiome intestinal évolue avec l’âge, favorisant des espèces générant une inflammation chronique au détriment de celles produisant des…
Ces dernières années, la recherche a mis en évidence l’influence de la composition du microbiome intestinal sur la santé à long terme ainsi que sur le vieillissement et les affections liées à l’âge. Des études ont établi des corrélations entre des espèces microbiennes spécifiques et des conditions de santé, montrant que l’ajustement de l’équilibre des…
L’âge intestinal est un concept central dans le vieillissement systémique, marqué par un déclin progressif de la structure et de la fonction intestinales. Les mécanismes principaux impliquent la dysrégulation du renouvellement des cellules épithéliales et la dysbiose du microbiote intestinal. Bien que le vieillissement intestinal ne soit souvent pas la cause principale de mortalité chez…

Le microbiome intestinal humain, une communauté microbienne dense et diversifiée, coexiste en harmonie symbiotique avec l’hôte tout en s’adaptant continuellement à l’environnement et au mode de vie de celui-ci tout au long de la vie. Cependant, des perturbations dans le microbiome intestinal, causées par des éléments intrinsèques ou extrinsèques, peuvent entraîner une dysbiose, ce qui…
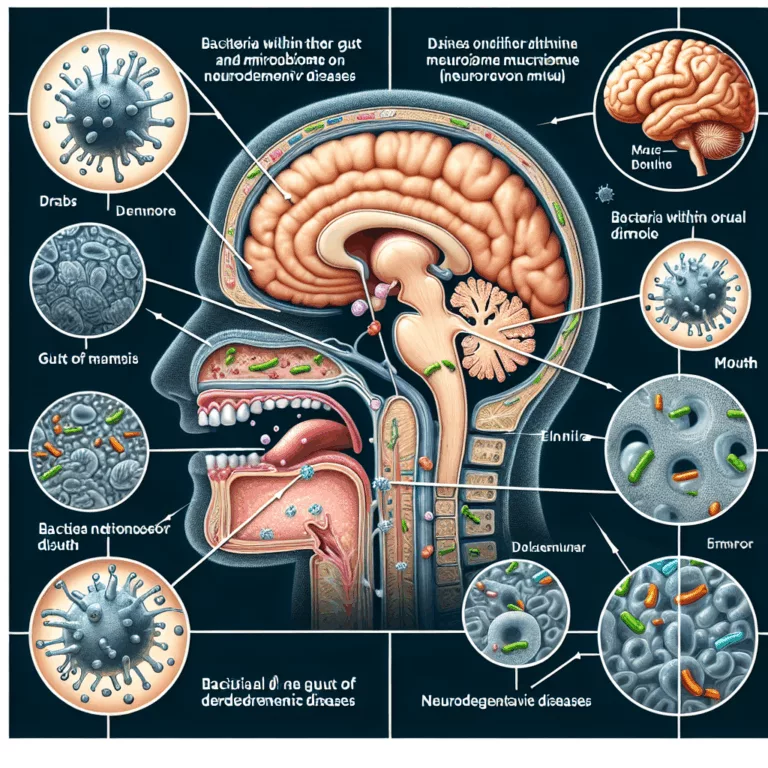
Ces dernières années, des chercheurs ont établi des corrélations entre l’état du microbiome intestinal et le développement de conditions neurodégénératives telles que la maladie d’Alzheimer et la maladie de Parkinson. Le déséquilibre des populations microbiennes constituant le microbiome intestinal change avec l’âge, favorisant une inflammation et une dysfonction accrues dans tout le corps. Il est…
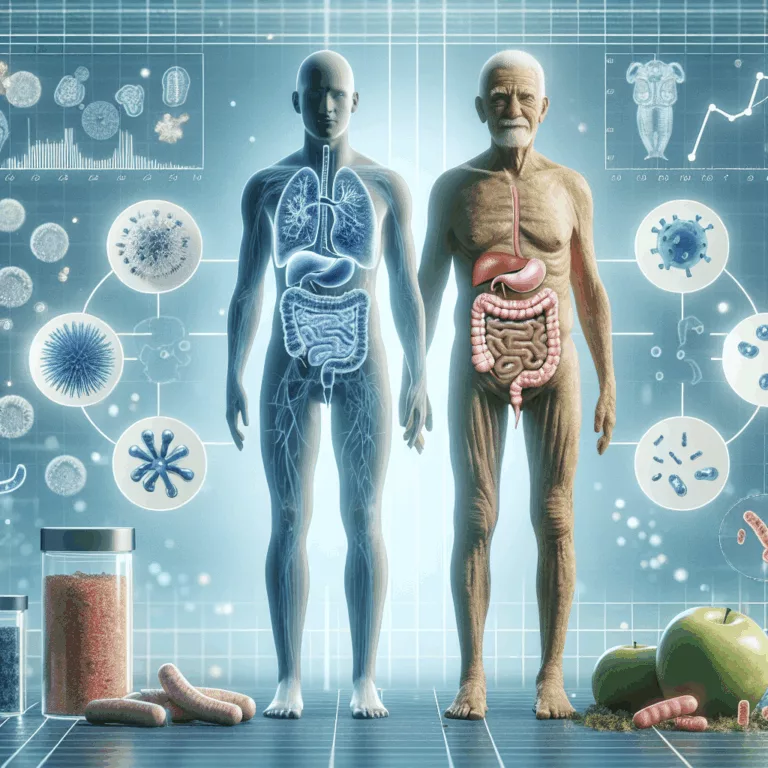
Le microbiome intestinal est un ensemble complexe de milliers d’espèces microbiennes qui coexistent dans notre intestin, dont certaines sont bénéfiques tandis que d’autres peuvent être nuisibles. La capacité de mesurer avec précision la composition de ce microbiome, notamment grâce au séquençage du gène 16S rRNA, a permis de faire le lien entre les changements dans…
La recherche sur le vieillissement met en lumière l’impact des dommages à l’ADN et de l’érosion des télomères comme des caractéristiques essentielles du processus de vieillissement. Les mécanismes par lesquels les changements dans les populations microbiennes du corps, en particulier le microbiome intestinal, influencent ces résultats sont discutés. L’inflammation, qui est exacerbée avec l’âge, joue…

Cet article en libre accès sert d’introduction aux horloges biologiques de vieillissement, un sujet qui suscite un intérêt croissant dans la recherche sur le vieillissement. Les horloges biologiques permettent d’estimer l’âge biologique d’un individu à partir de divers ensembles de données biologiques complexes. Cependant, le principal défi réside dans la difficulté à faire confiance aux…
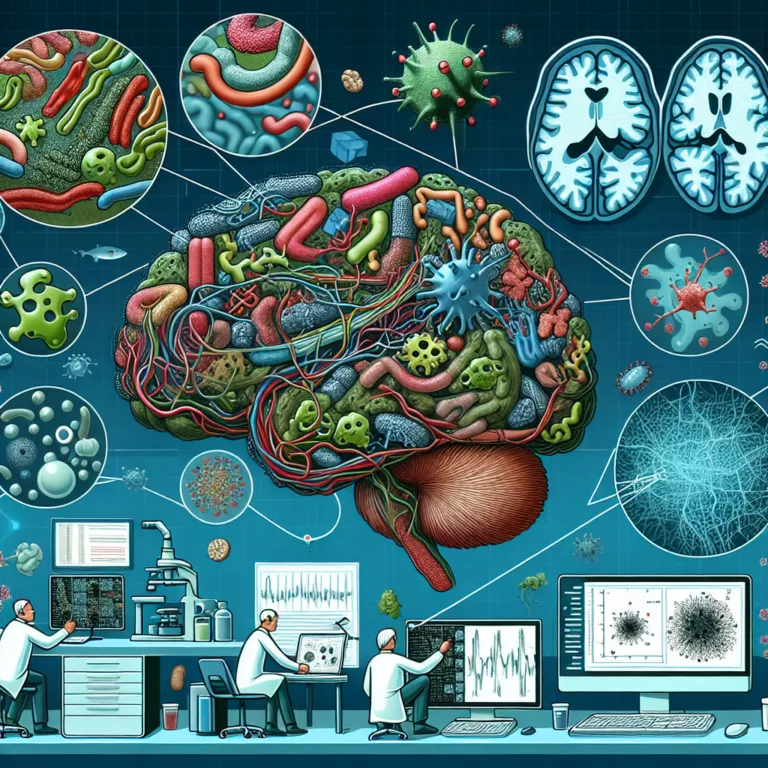
Au cours des dernières années, de nombreuses études ont révélé que les patients atteints de la maladie d’Alzheimer présentent une composition distincte de leur microbiome intestinal par rapport à des pairs du même âge. Le microbiome intestinal évolue avec l’âge, perdant des microbes bénéfiques et leur production de métabolites nécessaires au fonctionnement des tissus, tout…