Les mécanismes du vieillissement intestinal chez les mouches des fruits : Vers une approche thérapeutique
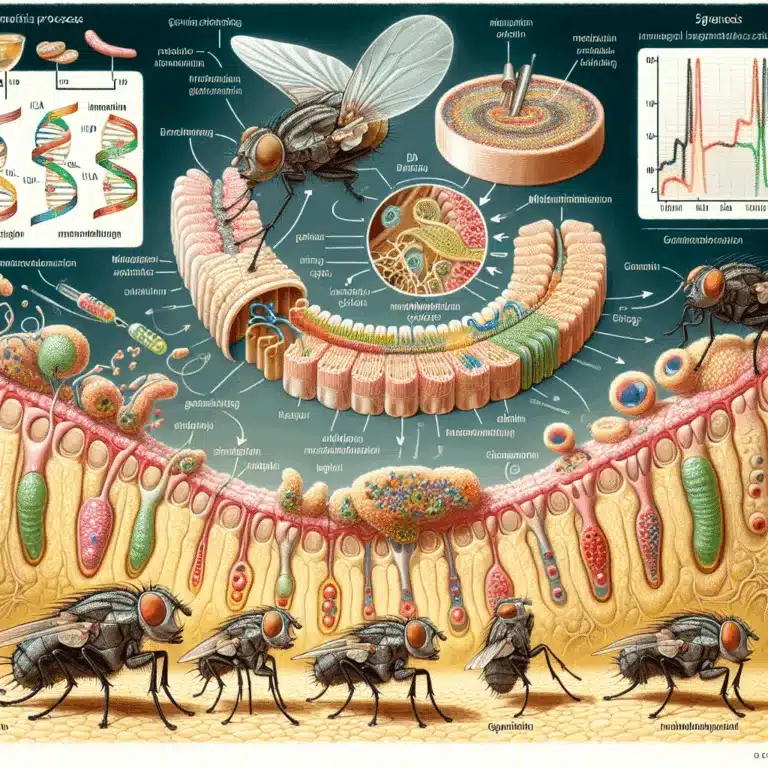
Les mouches des fruits, ou Drosophila melanogaster, sont couramment utilisées comme modèle pour étudier le vieillissement intestinal, car ce phénomène est un facteur majeur de mortalité dans cette espèce. Les chercheurs ont montré que les mouches meurent de dysfonction intestinale, tout comme les humains souffrent de maladies cardiovasculaires. Dans un article de recherche récent, les…