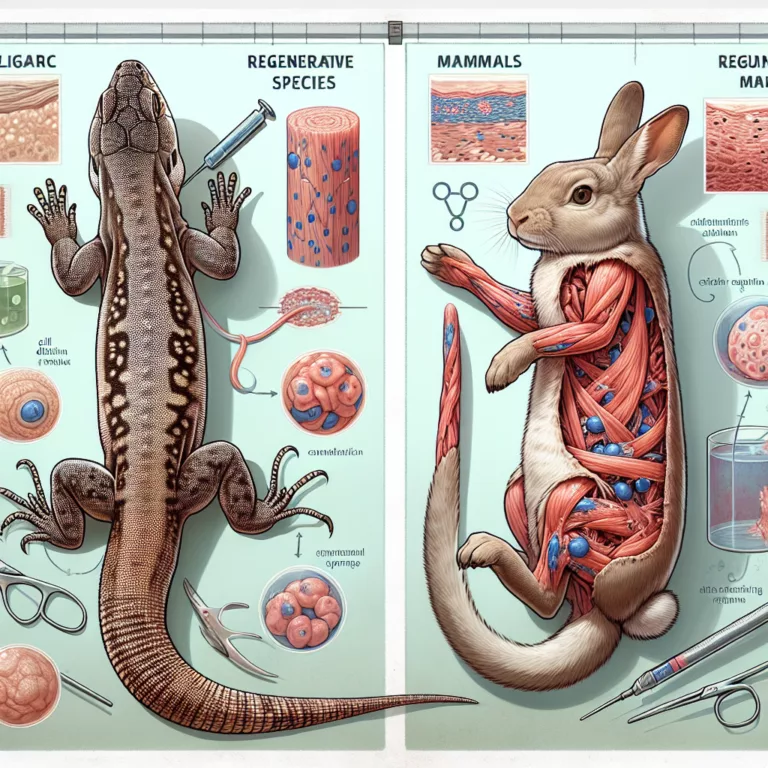
Régénération tissulaire : Études comparatives entre espèces régénératrices et mammifères
De nombreux groupes de recherche étudient la biochimie cellulaire des espèces hautement régénératrices telles que les salamandres et les poissons-zèbres. L’objectif est d’identifier les différences qui permettent la régénération des tissus perdus, contrairement à la cicatrisation observée chez les mammifères. Jusqu’à présent, il semble que de nombreuses différences concernent le maintien de processus de croissance…