NRG5051 : Une avancée prometteuse dans le traitement des maladies neurodégénératives
Découvrez comment NRG Therapeutics prépare le terrain pour NRG5051, un nouvel inhibiteur prometteur dans la lutte contre les maladies neurodégénératives.

Découvrez comment NRG Therapeutics prépare le terrain pour NRG5051, un nouvel inhibiteur prometteur dans la lutte contre les maladies neurodégénératives.
Découvrez comment les complexes Aβ/fibrinogène altèrent les synapses et la barrière hémato-encéphalique dans la maladie d’Alzheimer.

Découvrez comment un modèle cérébral innovant offre de nouvelles perspectives sur les maladies neurologiques et la médecine personnalisée.
Découvrez comment une nouvelle approche modifie la barrière hémato-encéphalique pour éliminer l’Amyloid-β et améliorer les traitements de la maladie d’Alzheimer.
L’hypertension, ou pression artérielle élevée, est une condition nocive qui affecte les tissus de tout le corps, notamment le cerveau. La pression accrue endommage directement la structure des tissus, perturbe leur fonction et modifie le comportement des cellules de manière défavorable. Cela a des conséquences particulièrement graves sur le cerveau, qui a une capacité limitée…
La maladie des petits vaisseaux cérébraux (cSVD) se réfère à des dysfonctionnements significatifs des petits vaisseaux sanguins du cerveau, englobant des conditions telles que la dysfonction endothéliale, les fuites de la barrière hémato-encéphalique, le raidissement des vaisseaux et les dommages causés par des ruptures mineures de vaisseaux. Les cliniciens diagnostiquent généralement la cSVD chez des…
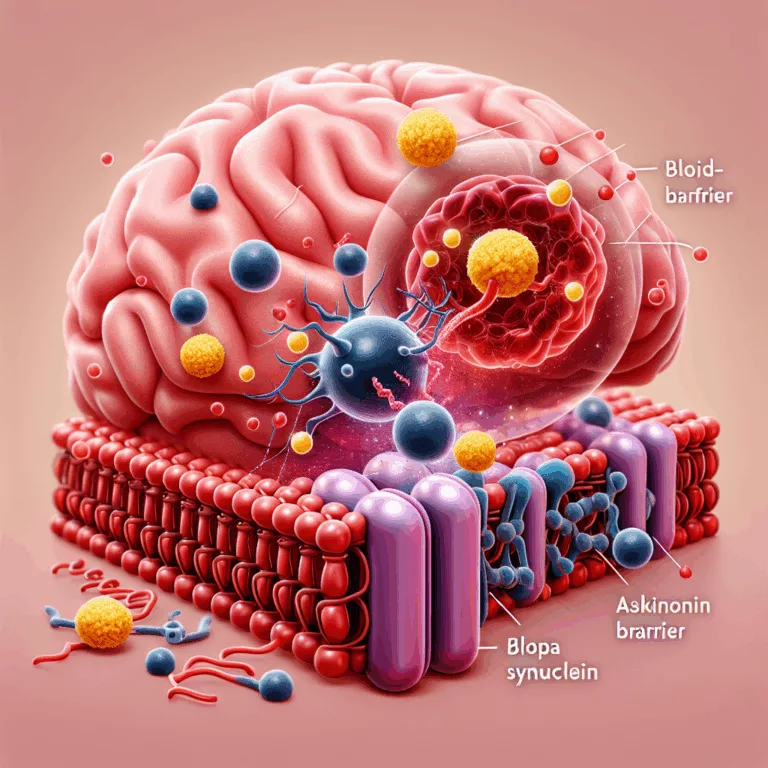
Les chercheurs ont découvert comment la protéine α-synucléine (α-syn), impliquée dans la maladie de Parkinson et la démence à corps de Lewy, entraîne une inflammation et une perturbation des axones dans le cerveau. Le cerveau est protégé par une barrière hémato-encéphalique (BHE) qui empêche de nombreuses substances dans le sang d’endommager les neurones. Les dommages…

Sironax, une entreprise de biotechnologie spécialisée dans le domaine de la longévité, a récemment annoncé un accord stratégique avec le géant pharmaceutique Novartis. Cet accord confère à Novartis une option exclusive d’acquérir la plateforme propriétaire de Sironax, conçue pour améliorer la livraison de traitements au travers de la barrière hémato-encéphalique (BHE). Cette étape permettra à…
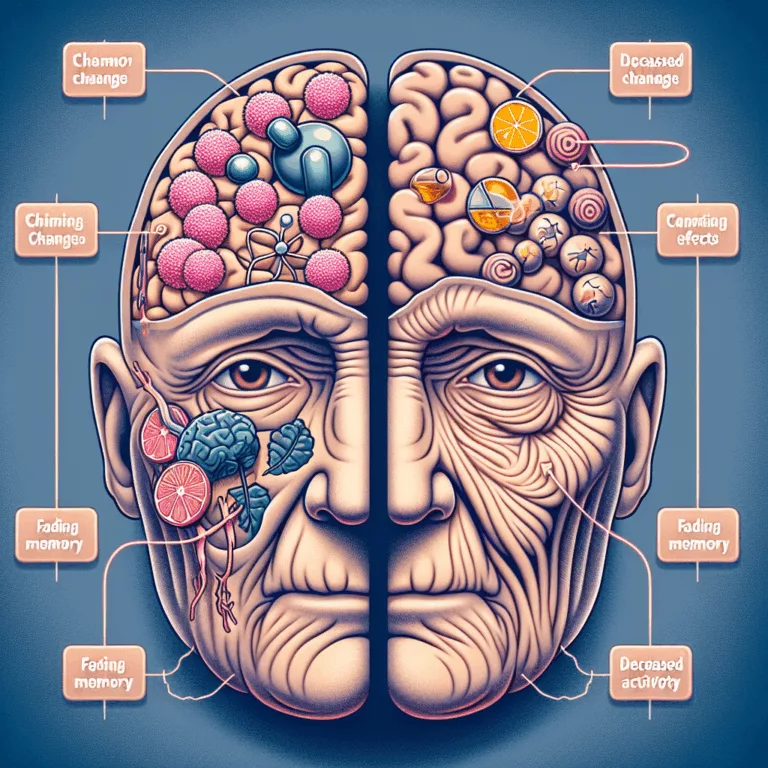
Le vieillissement est un processus complexe marqué par l’accumulation de dommages aux cellules et aux tissus, qui engendrent une série de conséquences interconnectées exacerbant le dysfonctionnement. Les recherches montrent que certaines conditions de déficit en réparation de l’ADN et l’utilisation intensive de la chimiothérapie pour traiter le cancer présentent des similitudes avec le vieillissement, surtout…
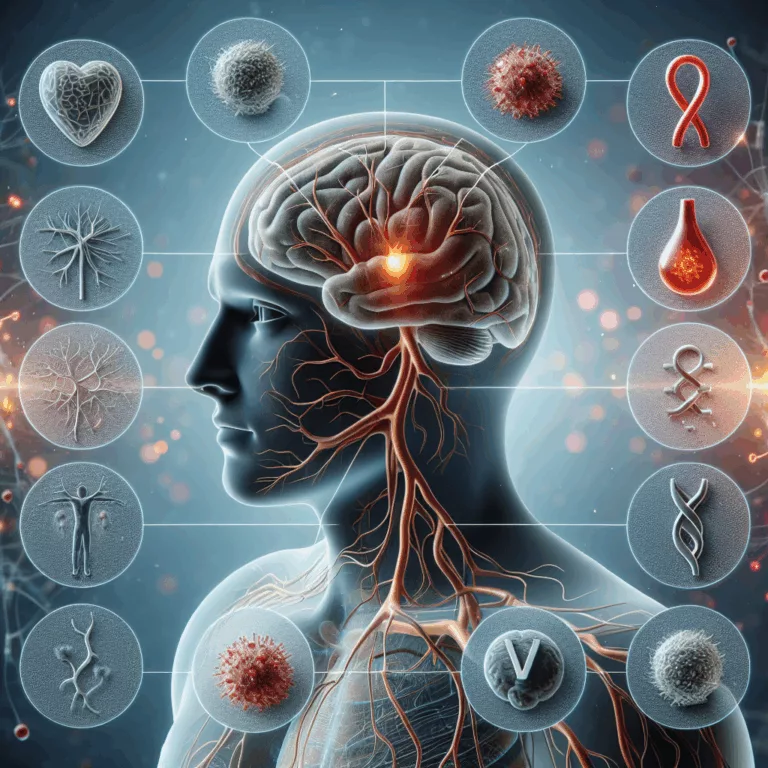
L’inflammation chronique est un élément majeur du vieillissement, perturbant la structure et la fonction des tissus. Ce texte examine les dysfonctionnements du système immunitaire associés à la maladie cérébrale des petits vaisseaux (cSVD), en notant diverses mesures reflétant l’inflammation. De nombreuses preuves indiquent que l’inflammation de l’endothélium vasculaire, la couche interne des vaisseaux sanguins, est…