Stimulation Électrique et Modulation des Macrophages pour la Régénération Tissulaire
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
Découvrez comment le complexe NMDAR/TRPM4 influence la progression de la maladie d’Alzheimer et explorez les nouvelles pistes thérapeutiques prometteuses.

NRG Therapeutics lève 67 millions de dollars pour développer des thérapies ciblant la dysfonction mitochondriale dans les maladies neurodégénératives. Découvrez leur approche innovante !

Le secteur de la longévité a récemment reçu un nouvel élan de confiance des investisseurs, alors que Seveno Capital, fondé par Allen Law, a acquis une participation stratégique dans Longevity.Technology, une plateforme en ligne dédiée à l’analyse de données et à l’innovation dans le domaine du vieillissement et de la santé. Cet investissement s’inscrit dans…
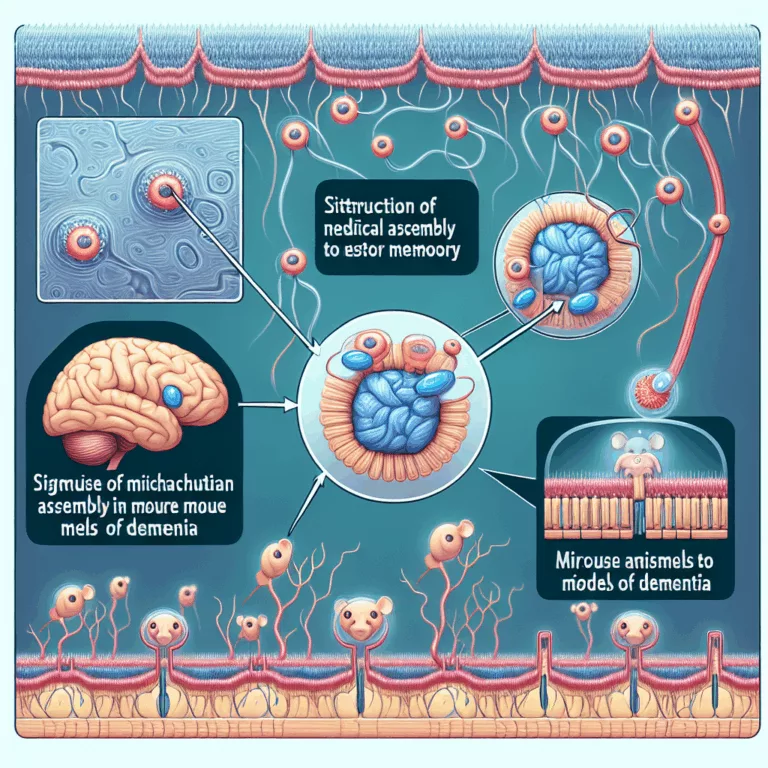
Des scientifiques ont découvert un moyen de stimuler directement l’assemblage du Complexe I dans les mitochondries, permettant de sauver des déficits de mémoire dans des modèles murins de la maladie d’Alzheimer et de la démence frontotemporale. De nombreuses maladies neurodégénératives, comme la maladie d’Alzheimer, sont associées à un dysfonctionnement mitochondrial, ce qui pourrait entraîner un…

Cet article aborde les recherches sur le rajeunissement des cellules et des tissus des mammifères, en se concentrant sur les effets de la circulation sanguine hétérochronique, de la dilution du plasma, de facteurs définis et du reprogrammation partielle. Les chercheurs explorent si la calibration simultanée des voies biologiques affectées par le vieillissement peut augmenter l’espérance…
Les cellules immunitaires innées, notamment les monocytes et les macrophages, jouent un rôle crucial dans le fonctionnement des tissus corporels. Avec l’âge, ces cellules peuvent devenir dysfonctionnelles, notamment en devenant plus inflammatoires. Contrairement à d’autres parties du corps, le cerveau possède sa propre population de cellules similaires, appelées microglies. Il est donc intéressant de noter…

Le principal défi auquel sont confrontées les thérapies géniques pour le traitement du vieillissement et des maladies liées à l’âge réside dans l’absence de systèmes de livraison efficaces. Actuellement, il n’existe pas de méthode bien établie pour délivrer en toute sécurité et de manière robuste une charge de taille suffisante à la plupart des organes,…

Fight Aging! est une publication qui se concentre sur l’éradication des maladies liées à l’âge grâce à la maîtrise des mécanismes du vieillissement par la médecine moderne. Le bulletin d’information hebdomadaire est envoyé à des milliers d’abonnés. En plus des nouvelles, Fight Aging! propose des services de conseil stratégique pour les investisseurs et entrepreneurs dans…

Le secteur de la longévité connaît une croissance rapide, avec de nombreuses cliniques, suppléments et tests biologiques promettant de ralentir, d’arrêter ou même de renverser le vieillissement. Cependant, les bases scientifiques de ces promesses sont souvent insuffisantes. Un défi majeur réside dans l’absence de biomarqueurs validés de manière universelle pour mesurer le vieillissement, ce qui…