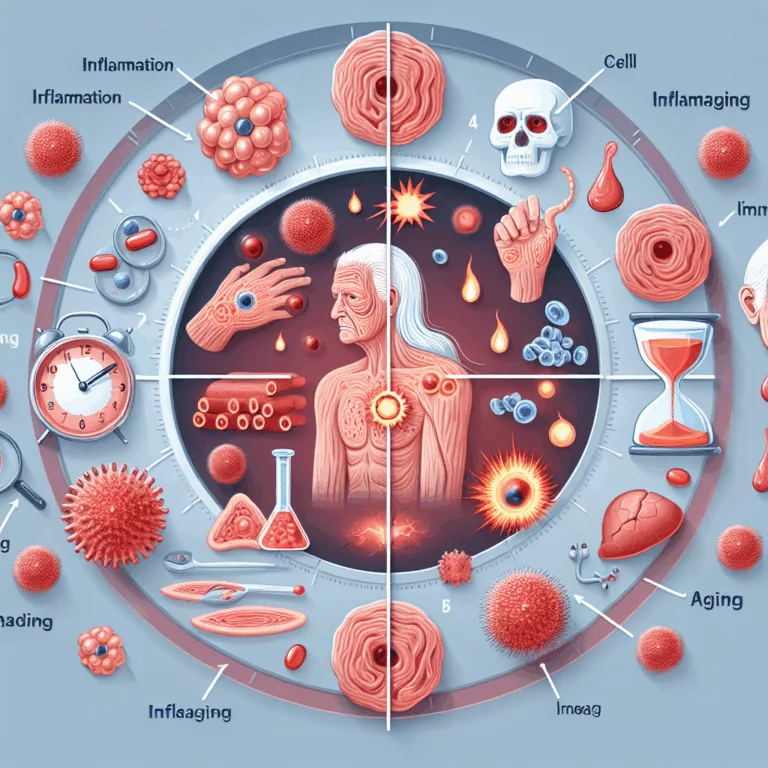
L’inflammaging et ses variations entre populations : le cas des chasseurs-cueilleurs
Les populations modernes de chasseurs-cueilleurs, telles que les Tsimane et les Hadza, suscitent un intérêt croissant de la part des chercheurs, notamment en raison de publications récentes indiquant qu’elles présentent des niveaux de maladies cardiovasculaires très faibles par rapport aux populations des pays plus riches. Cette différence pourrait être attribuée à des niveaux élevés et…