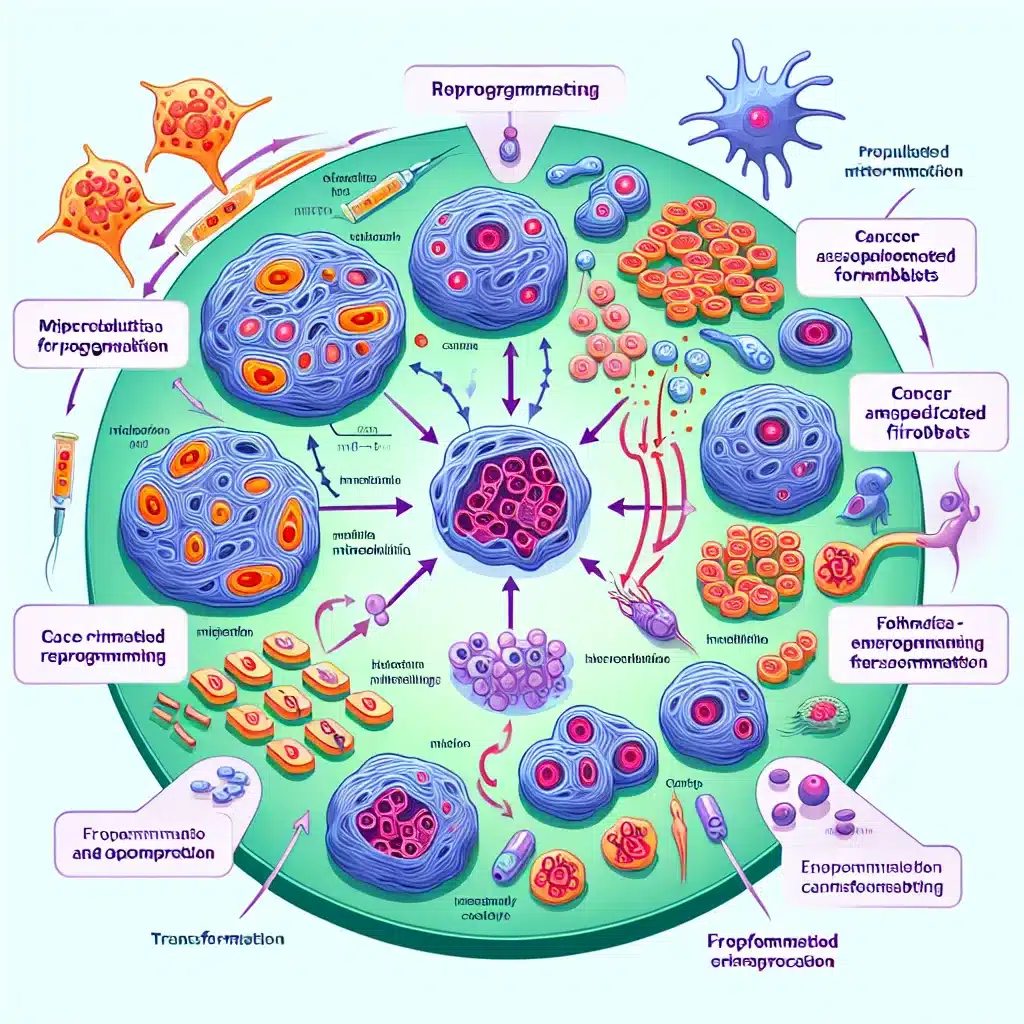
Le rôle des mitochondries dans la reprogrammation des fibroblastes associés au cancer
Les scientifiques ont découvert que les cellules cancéreuses recrutent des fibroblastes pour soutenir la croissance tumorale en leur transférant des mitochondries. Cette découverte ouvre de nouvelles pistes pour le traitement du cancer. En effet, les cellules cancéreuses ne fonctionnent pas seules ; leur succès repose souvent sur la coopération avec les cellules environnantes. Ces dernières peuvent parfois donner des mitochondries aux cellules cancéreuses, ce qui booste leur métabolisme et favorise la croissance tumorale. Dans le cas du cancer de la peau, des transferts mitochondriaux entre fibroblastes associés au cancer (CAF) et cellules cancéreuses ont été observés. Pour la première fois, une équipe de chercheurs de l’ETH Zurich a montré que le phénomène inverse se produit également : les cellules cancéreuses transfèrent des mitochondries à des CAF. Les CAF jouent un rôle clé dans le microenvironnement tumoral en construisant et maintenant le système de soutien de la tumeur. Dans leur étude publiée dans Nature Cancer, les chercheurs ont co-cultivé des cellules cancéreuses cutanées A431 avec des fibroblastes humains primaires. En marquant les mitochondries, ils ont pu confirmer que certaines d’entre elles se retrouvaient dans les fibroblastes. Le transfert mitochondrial est un phénomène répandu, se produisant également lors de la guérison des blessures, et peut se faire de plusieurs manières. Les chercheurs ont cependant pu écarter toutes les méthodes sauf une : le transfert par des nanotubes de tunneling (TNT), qui sont des ponts membranaires fins et basés sur l’actine, permettant le transport direct d’organelles et de signaux entre les cellules. Ces résultats suggèrent que les cellules cancéreuses étendent des TNT pour livrer directement leurs mitochondries aux fibroblastes. Ce transfert a également été observé avec des cellules cancéreuses du sein et du pancréas. Pourquoi les cellules cancéreuses transfèrent-elles des mitochondries précieuses à d’autres cellules ? Les chercheurs ont découvert que les fibroblastes ayant reçu des mitochondries de cellules cancéreuses présentent une augmentation de l’expression de plusieurs gènes liés aux phénotypes des CAF et à la construction de la matrice extracellulaire (MEC), ce qui stimule leur prolifération. En gros, le transfert mitochondrial des cellules cancéreuses cause une reprogrammation des fibroblastes normaux vers des CAF. Des essais ont montré une augmentation de la phosphorylation oxydative et des fuites de protons dans les fibroblastes récepteurs, indiquant que leur machinerie énergétique fonctionnait à plein régime. Le traitement avec de l’oligomycine, qui empêche la production d’énergie par les mitochondries, a bloqué à la fois l’induction des marqueurs CAF et la prolifération. Pour prouver que les mitochondries seules étaient responsables de cette transformation, les scientifiques ont isolé des mitochondries directement à partir de cellules cancéreuses et les ont transplantées dans des fibroblastes normaux, induisant les mêmes changements similaires à ceux des CAF. Il est crucial de noter que toutes les mitochondries ne sont pas égales ; celles provenant de cellules non cancéreuses avaient peu d’effet, tandis que celles de cellules cancéreuses plus malignes avaient un effet plus fort. Lorsque des mitochondries dysfonctionnelles étaient transférées, le fibroblaste ne se reprogrammait pas et ne soutenait pas la croissance tumorale chez les souris. Dans les expériences in vivo, la co-injection de cellules A431 avec des fibroblastes ayant reçu des mitochondries A431 a produit des tumeurs plus grandes et une angiogenèse accrue. Cela a soulevé la question de savoir quel facteur tumoral contrôle ce transfert. En analysant les données d’expression génique des cancers de la peau humains, l’équipe a identifié plusieurs gènes impliqués dans le transport mitochondrial, parmi lesquels un protéine, MIRO2, qui était significativement surexprimée dans les cellules cancéreuses, notamment aux bords invasifs des tumeurs où elles interagissent avec les fibroblastes. MIRO2 agit comme un moteur moléculaire, reliant les mitochondries au réseau de transport cellulaire pour contrôler leur position. Les chercheurs ont émis l’hypothèse que les cellules cancéreuses détournent MIRO2 pour déplacer leurs mitochondries en vue d’une livraison. Lorsque l’interférence par ARN a été utilisée pour réduire les niveaux de MIRO2 dans les cellules cancéreuses, les mitochondries se sont regroupées autour du noyau, réduisant la capacité des cellules à transférer des mitochondries aux fibroblastes et à les convertir en CAF. À l’inverse, augmenter les niveaux de MIRO2 dans les cellules cancéreuses a stimulé leur activité de transfert mitochondrial. En injectant des cellules cancéreuses déficientes en MIRO2 dans des souris, les cellules n’ont pas formé de tumeurs. Cependant, lorsque ces cellules déficientes en MIRO2 ont été co-injectées avec des fibroblastes chargés de mitochondries cancéreuses, cette combinaison a induit une croissance tumorale, suggérant que le rôle de MIRO2 était de provoquer la reprogrammation des fibroblastes en CAF, rôle crucial pour le développement du cancer. Les chercheurs sont optimistes quant à l’avenir de cette découverte, suggérant que le blocage de MIRO2 pourrait avoir des applications cliniques à long terme. Source : https://www.lifespan.io/news/cancer-cells-transfer-mitochondria-to-fibroblasts/?utm_source=rss&utm_medium=rss&utm_campaign=cancer-cells-transfer-mitochondria-to-fibroblasts