L’importance des biomarqueurs dans la médecine de longévité : Entretien avec Joseph Raffaele
Découvrez comment les biomarqueurs révolutionnent la médecine de longévité avec le Dr Joseph Raffaele au Global Longevity Summit 2025 à Genève.

Découvrez comment les biomarqueurs révolutionnent la médecine de longévité avec le Dr Joseph Raffaele au Global Longevity Summit 2025 à Genève.

Découvrez comment l’environnement local du cerveau influence le vieillissement des microglies et impacte notre longévité cognitive.

Fight Aging! est une publication qui se concentre sur l’éradication des maladies liées à l’âge grâce à la maîtrise des mécanismes du vieillissement par la médecine moderne. Le bulletin d’information hebdomadaire est envoyé à des milliers d’abonnés. En plus des nouvelles, Fight Aging! propose des services de conseil stratégique pour les investisseurs et entrepreneurs dans…

Découvrez comment le vol spatial influence le vieillissement des cellules souches et ses implications pour la santé des astronautes et la science de la longévité.

Découvrez la Conférence sur les Biomarqueurs du Vieillissement 2025 : un événement clé pour l’intégration clinique des mesures de l’âge biologique à Harvard.
Découvrez comment une nouvelle voie régulatrice de l’agrégation des protéines pourrait transformer notre compréhension des maladies neurodégénératives liées à l’âge.
Au cours des dernières années, les chercheurs ont développé de nombreuses horloges de vieillissement utilisant des techniques d’apprentissage automatique appliquées à de grandes quantités de données biologiques. Ces horloges ont pour but de prédire l’âge chronologique, le risque de mortalité et d’autres mesures d’intérêt. Si une personne présente un âge prédit supérieur à son âge…
Le microbiome intestinal a suscité un grand intérêt ces dernières années, grâce à la possibilité d’évaluer de manière précise et économique sa composition par le séquençage de l’ARN ribosomal 16S. Les recherches montrent que la composition du microbiome intestinal évolue avec l’âge, favorisant des espèces générant une inflammation chronique au détriment de celles produisant des…
Une étude récente a examiné les rôles du tissu adipeux brun (TAB) et d’une hormone lipidique, le 12,13-diHOME, dans la santé cardiaque, en se concentrant sur les mécanismes moléculaires affectant les cœurs de souris âgées. Le vieillissement entraîne des changements dans le système cardiovasculaire, notamment des perturbations du métabolisme du calcium, et le TAB, qui…
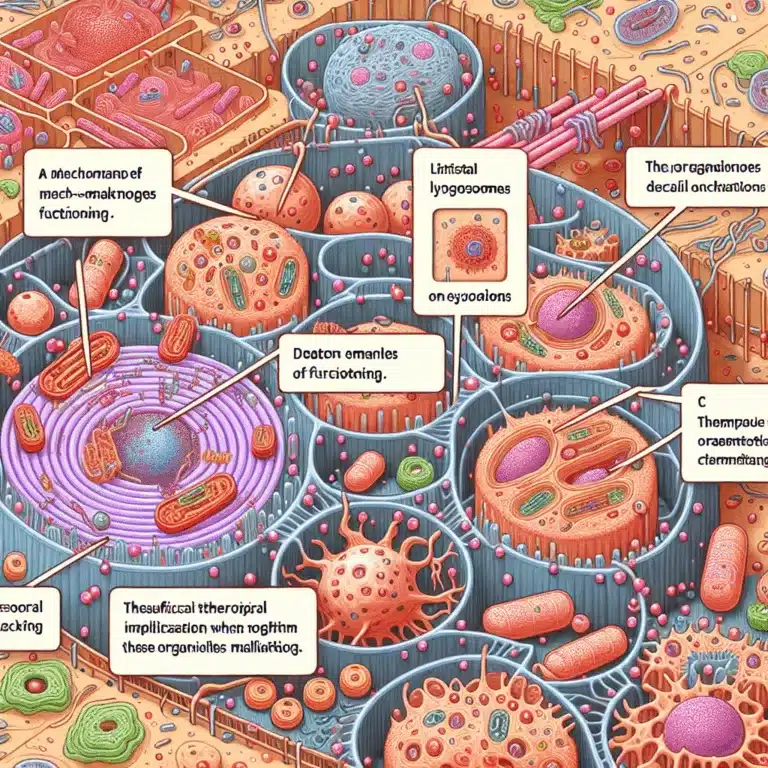
Les lysosomes sont des organites essentiels au sein des cellules, servant de systèmes de recyclage grâce à des enzymes capables de décomposer les protéines et les structures cellulaires en matières premières réutilisables. Le processus d’autophagie (optimiser l’autophagie par le jeûne) est responsable de l’identification des protéines et des structures à recycler, qui sont ensuite livrées…