Une Révolution dans l’Étude des Maladies Neurologiques : Le Modèle Cérébral Multicellulaire
Découvrez comment un modèle cérébral innovant offre de nouvelles perspectives sur les maladies neurologiques et la médecine personnalisée.

Découvrez comment un modèle cérébral innovant offre de nouvelles perspectives sur les maladies neurologiques et la médecine personnalisée.
Le domaine de l’ingénierie tissulaire vise à produire des structures de tissus artificiels capables de soutenir des cellules et de s’intégrer au tissu natif lorsqu’elles sont implantées dans une lésion, favorisant ainsi la régénération qui n’aurait pas eu lieu autrement. À long terme, l’objectif est de créer des organes entièrement artificiels et fonctionnels. Cependant, la…
L’inflammation chronique est un élément majeur du vieillissement, perturbant la structure et la fonction des tissus. Ce texte examine les dysfonctionnements du système immunitaire associés à la maladie cérébrale des petits vaisseaux (cSVD), en notant diverses mesures reflétant l’inflammation. De nombreuses preuves indiquent que l’inflammation de l’endothélium vasculaire, la couche interne des vaisseaux sanguins, est…
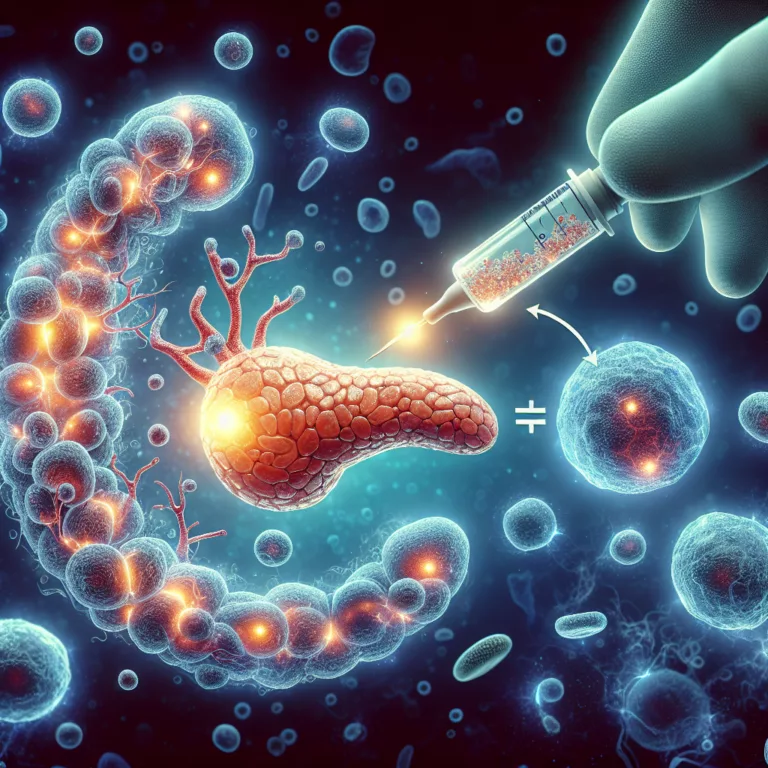
Dans une étude publiée dans *Cell Reports Medicine*, des chercheurs ont réussi à créer un pancréas fonctionnel à partir de cellules humaines, qui a montré son efficacité chez des souris. Cette recherche se concentre sur les défis des injections d’insuline pour traiter le diabète de type 1, en soulignant que le suivi constant et les…
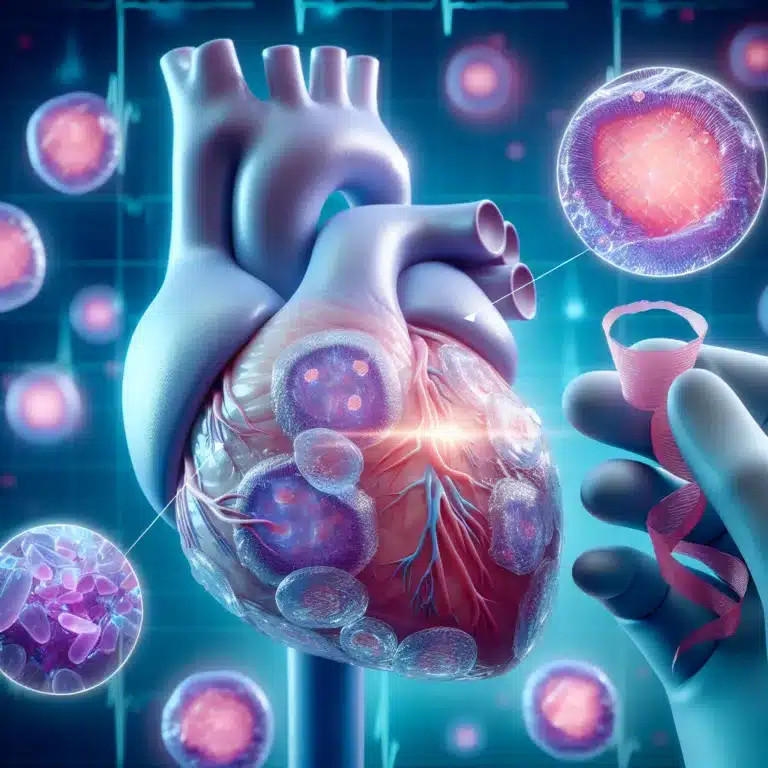
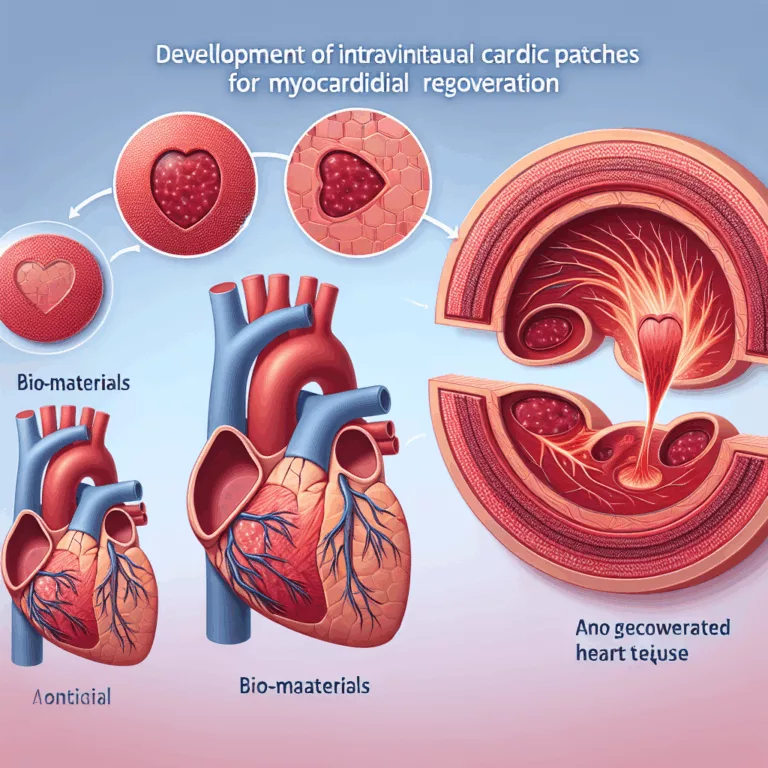
Des scientifiques allemands ont réussi à créer des « patchs » de tissu musculaire cardiaque cultivés en laboratoire à partir de cellules souches pluripotentes. Après des succès sur des singes rhésus, ils ont obtenu l’approbation pour un essai clinique sur des humains. Le muscle cardiaque, étant l’un des tissus les plus sollicités du corps, subit une usure…