Vers une révolution thérapeutique : l’ingénierie des mitochondries pour lutter contre le vieillissement
Découvrez comment l’ingénierie des mitochondries pourrait transformer la médecine anti-âge en améliorant la fonction cellulaire.

Découvrez comment l’ingénierie des mitochondries pourrait transformer la médecine anti-âge en améliorant la fonction cellulaire.

Découvrez comment les rats-taupes nus défient le vieillissement et le cancer, révélant des pistes prometteuses pour la recherche médicale.
Découvrez comment Genflow Biosciences révolutionne la santé animale avec sa thérapie génique SIRT6, promettant une vie plus longue et en meilleure santé pour nos chiens.
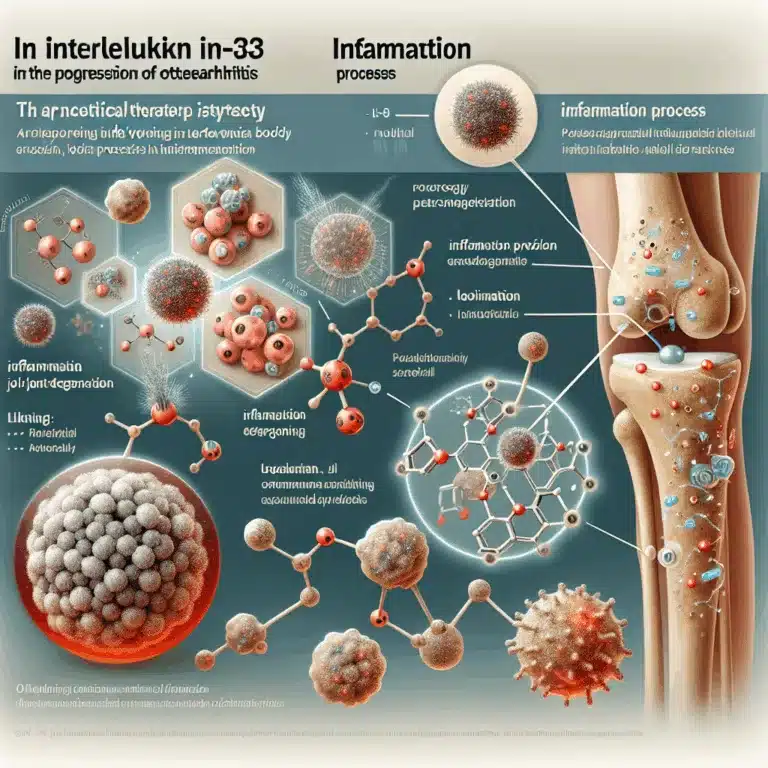
Découvrez comment l’IL-33 influence l’arthrose et explorez une stratégie innovante avec des nanoparticules pour ralentir sa progression.

Découvrez comment l’accord entre Phoenix et MD Anderson révolutionne les thérapies cellulaires et ouvre de nouvelles perspectives en médecine de longévité.

L’article explore l’impact des zones économiques spéciales sur le développement de thérapies géniques axées sur la longévité, en mettant en lumière l’entreprise Unlimited Bio. Unlimited Bio et la thérapie génique VEGF Cette société, fondée par Ivan Morgunov et ses partenaires, propose des traitements tels que la thérapie génique VEGF, qui stimule la croissance de nouveaux…

Découvrez comment une étude novatrice sur la thérapie génique pourrait transformer le traitement de l’infarctus du myocarde chez les primates non humains.

Le principal défi auquel sont confrontées les thérapies géniques pour le traitement du vieillissement et des maladies liées à l’âge réside dans l’absence de systèmes de livraison efficaces. Actuellement, il n’existe pas de méthode bien établie pour délivrer en toute sécurité et de manière robuste une charge de taille suffisante à la plupart des organes,…
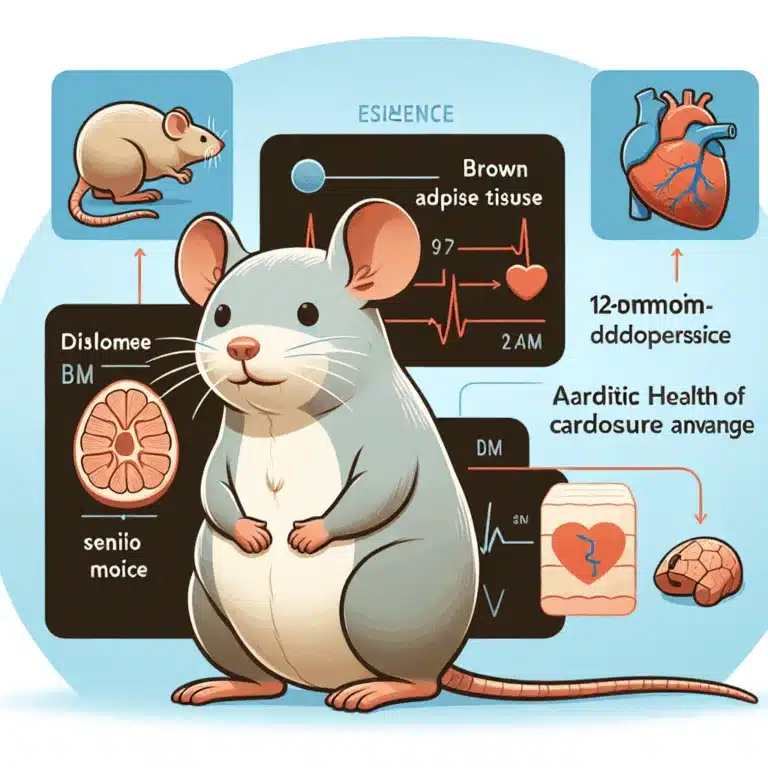
Une étude récente a examiné les rôles du tissu adipeux brun (TAB) et d’une hormone lipidique, le 12,13-diHOME, dans la santé cardiaque, en se concentrant sur les mécanismes moléculaires affectant les cœurs de souris âgées. Le vieillissement entraîne des changements dans le système cardiovasculaire, notamment des perturbations du métabolisme du calcium, et le TAB, qui…

Arrowhead Pharmaceuticals a signé un accord de licence et de collaboration mondiale avec Novartis pour le développement d’ARO-SNCA, une thérapie expérimentale d’interférence ARN visant à cibler l’alpha-synucléine dans le traitement des synucléinopathies, notamment la maladie de Parkinson. Ce programme préclinique utilise la plateforme TRiM (Targeted RNAi Molecule) d’Arrowhead, qui permet l’administration sous-cutanée et la livraison…