Le rôle des macrophages sénescents dans l’évolution des tumeurs : un équilibre délicat
Découvrez comment les macrophages sénescents influencent la croissance tumorale et l’évasion immunitaire dans le microenvironnement tumoral.

Découvrez comment les macrophages sénescents influencent la croissance tumorale et l’évasion immunitaire dans le microenvironnement tumoral.
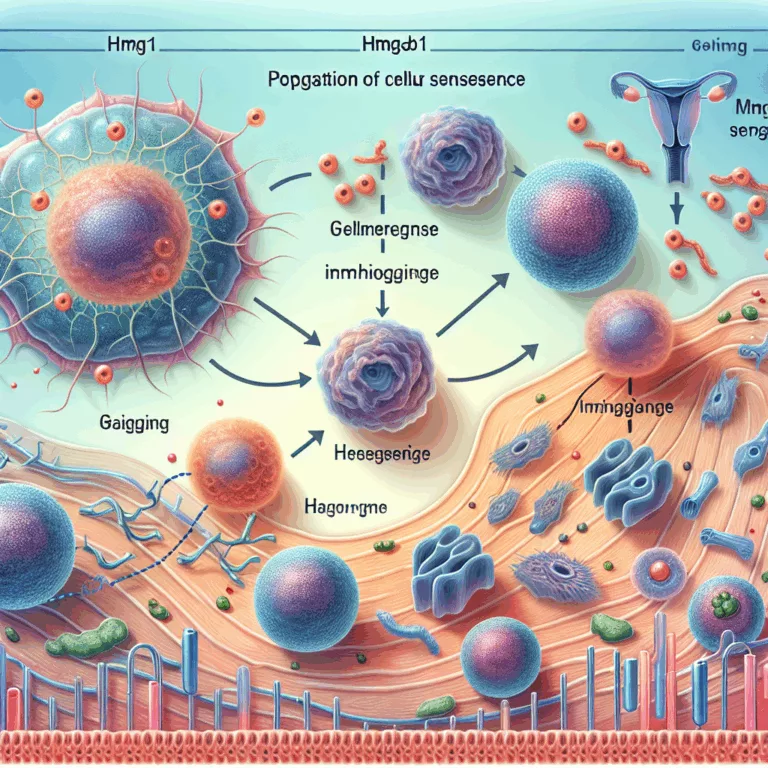
Cet article publié dans la revue *Metabolism Clinical & Experimental* présente des recherches sur le facteur HMGB1 et son rôle dans la propagation de la sénescence cellulaire. La sénescence cellulaire est un état où les cellules ne se divisent plus et émettent des signaux chimiques nocifs, connus sous le nom de phénotype sécrétoire associé à…
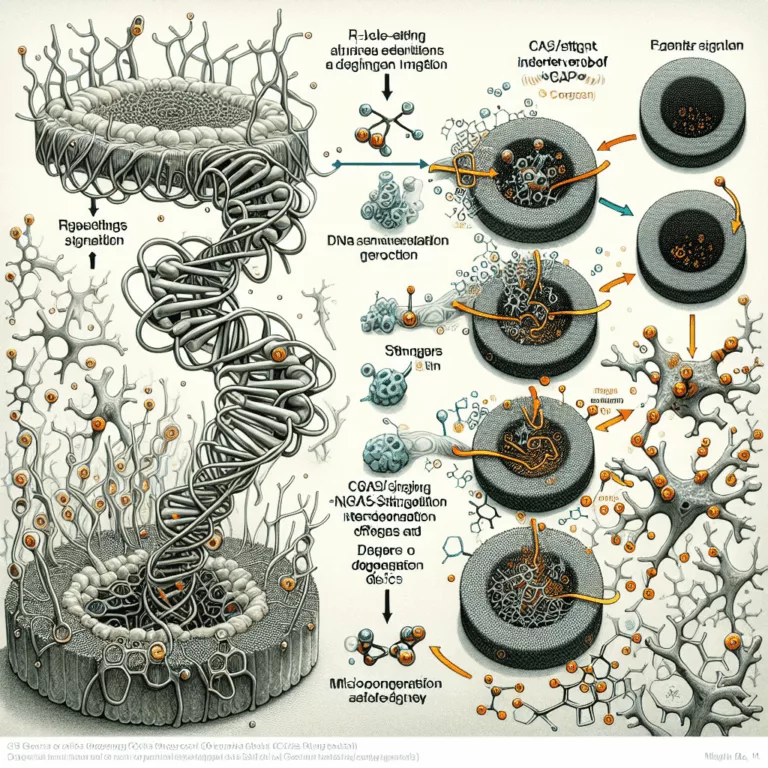
Le texte aborde les divers aspects de la structure de l’ADN nucléaire et son impact sur l’expression génique, en se concentrant sur le rôle des marques épigénétiques et des structures temporaires comme les R-loops. Les R-loops se forment lorsque des séquences d’ARN se fixent à l’ADN double brin, potentiellement en raison d’échecs de transcription, ce…
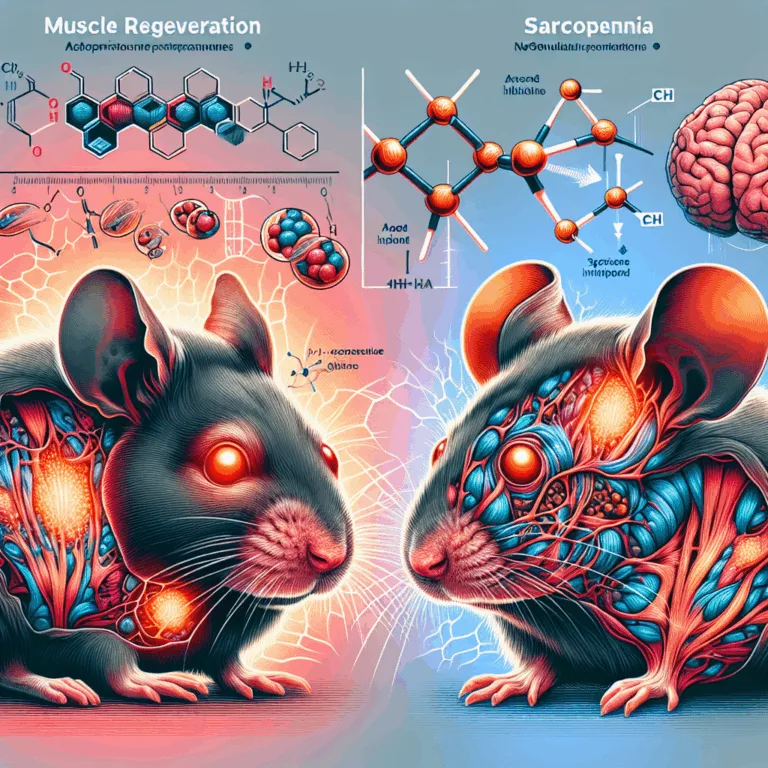
Les chercheurs ont découvert que l’ingénierie génétique visant à réduire l’expression de HDAC11 modifie favorablement le métabolisme des tissus musculaires chez les souris, quel que soit leur âge. Cette modification ralentit la perte de masse et de force musculaires, bien connue chez les souris âgées, et améliore la régénération musculaire. Des petites molécules inhibitrices de…
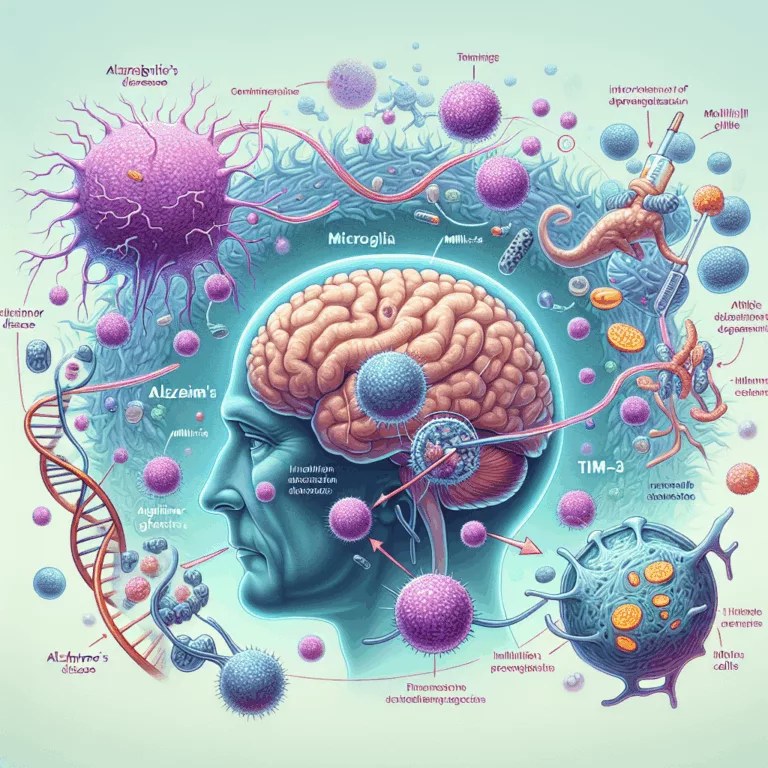
Le système immunitaire du système nerveux central (SNC) diffère de celui du reste du corps, bien qu’il existe une interaction significative entre les deux. Les cellules immunitaires innées, connues sous le nom de microglies, jouent un rôle crucial dans la défense contre les pathogènes, l’élimination des déchets métaboliques et le maintien des connexions synaptiques entre…