Découvrez Life Time Prudential Center : Un Sanctuaire de Bien-Être au Cœur de Boston
Explorez le nouveau Life Time Prudential Center à Boston, un espace de bien-être intégrant fitness, récupération et socialisation.

Explorez le nouveau Life Time Prudential Center à Boston, un espace de bien-être intégrant fitness, récupération et socialisation.

Découvrez comment l’expertise du Prof. Raal propulse Repair Biotechnologies vers de nouvelles avancées dans le traitement des maladies liées au cholestérol.

Découvrez le nouveau Centre Anti-Vieillissement Serotonin à Joplin : des traitements innovants pour rajeunir votre corps et votre esprit. Ne manquez pas l’ouverture !
Découvrez comment le buntanetap d’Annovis Bio pourrait transformer le traitement de la maladie d’Alzheimer en modifiant sa biologie sous-jacente.

Découvrez comment améliorer la fonction mitochondriale pourrait inverser le déclin lié à l’âge et favoriser une meilleure santé cellulaire.

Découvrez comment Dominik Thor révolutionne la médecine de la longévité en intégrant science et innovation pour un avenir médical éclairé.

Aviv Clinics a annoncé une nouvelle étude de cohorte rétrospective démontrant que la thérapie à l’oxygène hyperbare (HBOT) peut améliorer de manière significative les résultats cognitifs chez les adultes ayant subi un traumatisme crânien (TBI) durant l’enfance et continuant à éprouver un syndrome post-commotionnel (PCS). Cette recherche a été réalisée par le Sagol Center for…
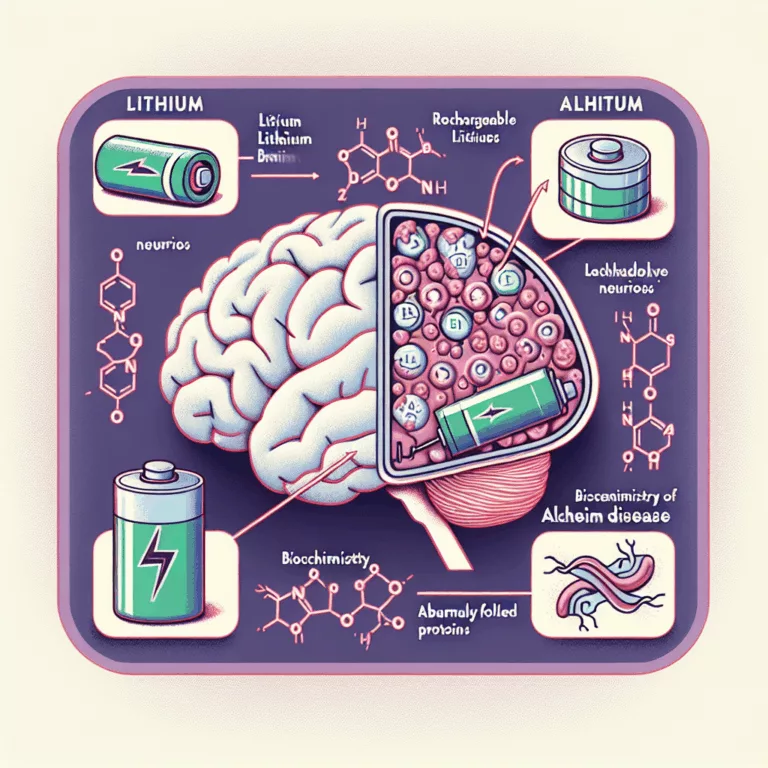
Une étude récente a mis en évidence le rôle crucial du lithium dans la santé cérébrale et le développement de troubles cognitifs légers ainsi que de la maladie d’Alzheimer. L’utilisation d’un sel de lithium, le lithium orotate, pourrait inverser de nombreux changements associés au déclin cognitif au niveau moléculaire et cellulaire. Les chercheurs ont examiné…
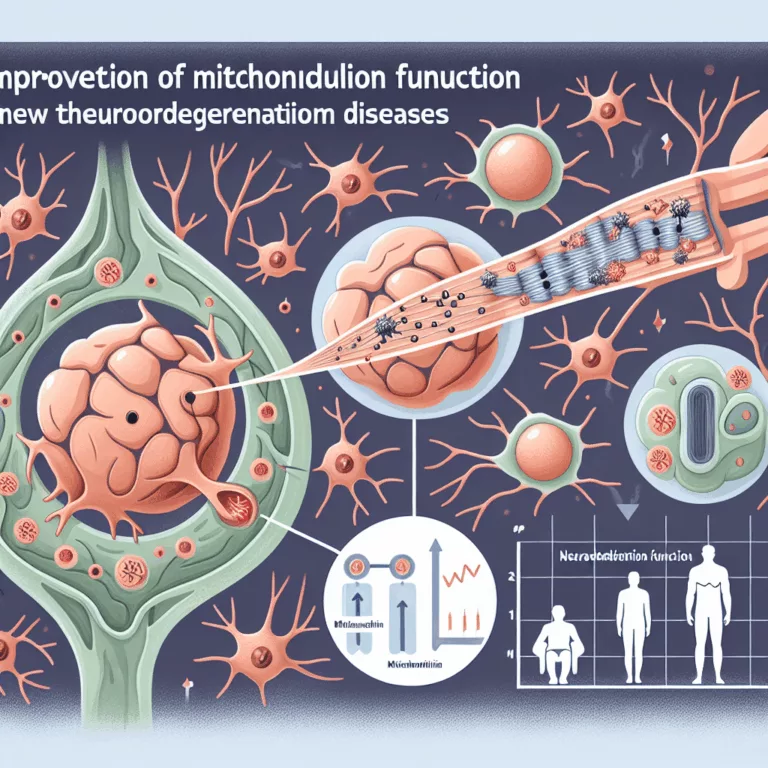
Les mitochondries sont des organites essentiels responsables de la production d’ATP, la molécule qui stocke l’énergie chimique nécessaire aux processus biochimiques. Considérées comme les descendants lointains de bactéries symbiotiques, chaque cellule humaine abrite des centaines de mitochondries. Avec l’âge, la fonction mitochondriale diminue pour diverses raisons complexes, notamment des dommages, des modifications de l’expression génique…

Une nouvelle recherche de l’École de Médecine de Harvard et de ses collaborateurs révèle que la déplétion naturelle en lithium dans le cerveau précède les symptômes de la maladie d’Alzheimer et pourrait offrir une voie thérapeutique sûre pour la prévention et le traitement. Traditionnellement associé à la psychiatrie et au traitement du trouble bipolaire, le…