Comprendre la sénescence cellulaire : un marqueur clé du vieillissement humain
Découvrez comment la sénescence cellulaire influence la santé liée à l’âge et son rôle dans l’inflammation chronique.
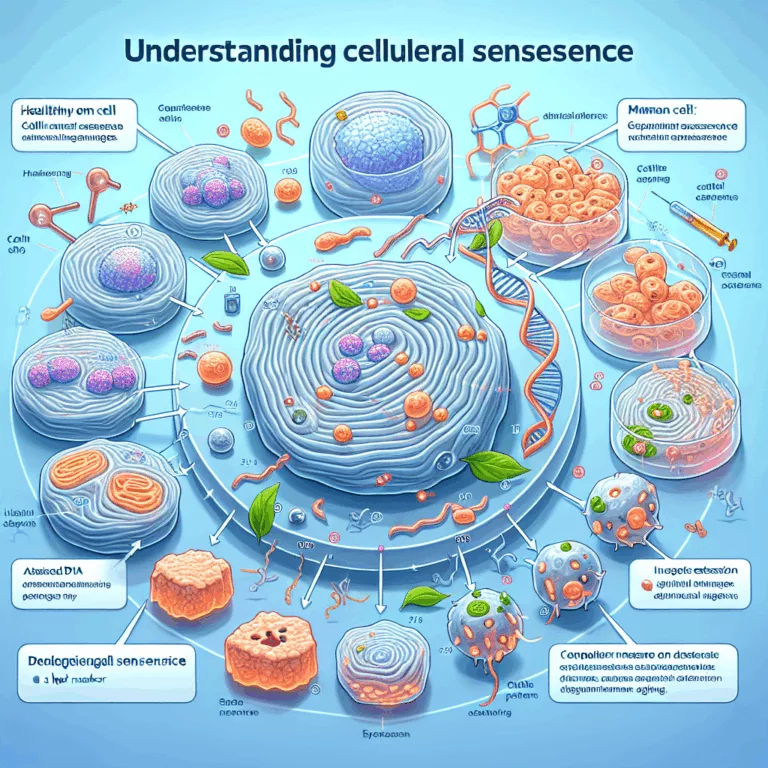
Découvrez comment la sénescence cellulaire influence la santé liée à l’âge et son rôle dans l’inflammation chronique.

Découvrez comment l’exercice physique améliore le système immunitaire des personnes âgées et réduit les risques de maladies graves.
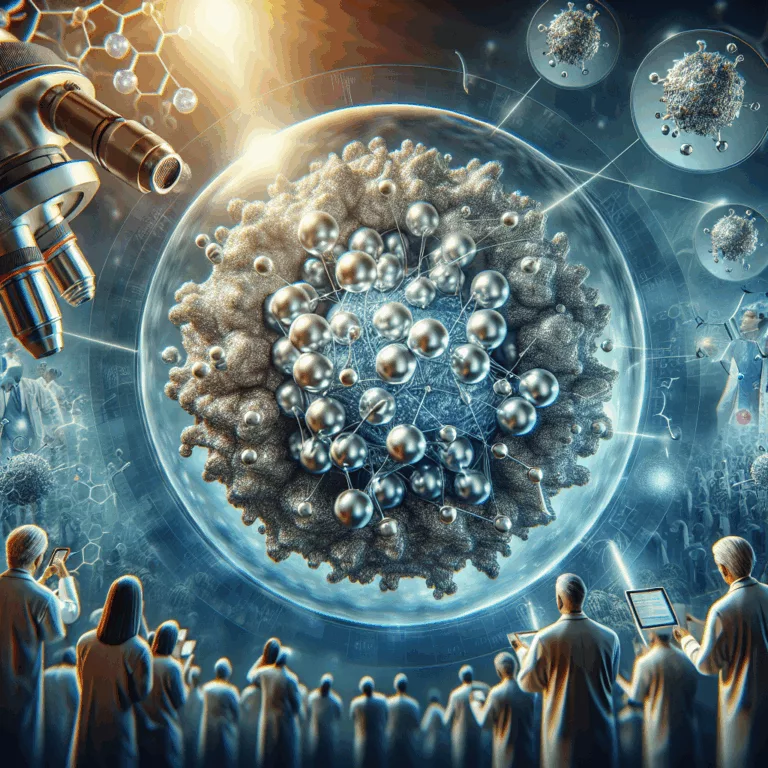
Découvrez comment une nouvelle plateforme de nanoparticules pourrait transformer les vaccins anticancéreux en stimulant efficacement le système immunitaire.

Découvrez comment les macrophages sénescents influencent la croissance tumorale et l’évasion immunitaire dans le microenvironnement tumoral.

Découvrez comment l’astroimmunologie révèle le lien entre le vol spatial et le déclin immunitaire, avec des implications pour la longévité sur Terre.

Découvrez comment les centenaires maintiennent un système immunitaire jeune et efficace, défiant les normes du vieillissement.
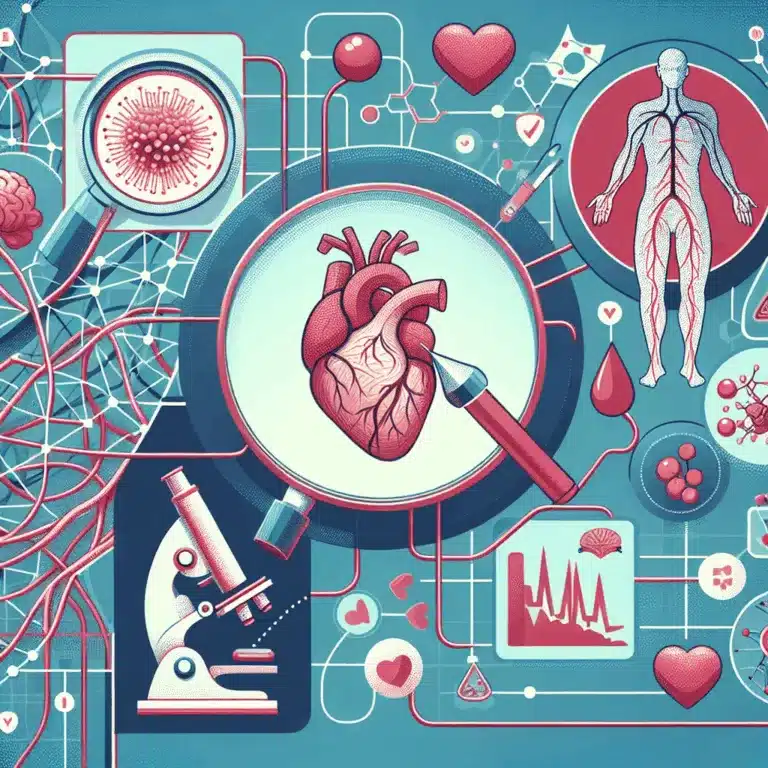
Découvrez comment la sénescence cellulaire influence les maladies cardiovasculaires et explorez des approches thérapeutiques innovantes.
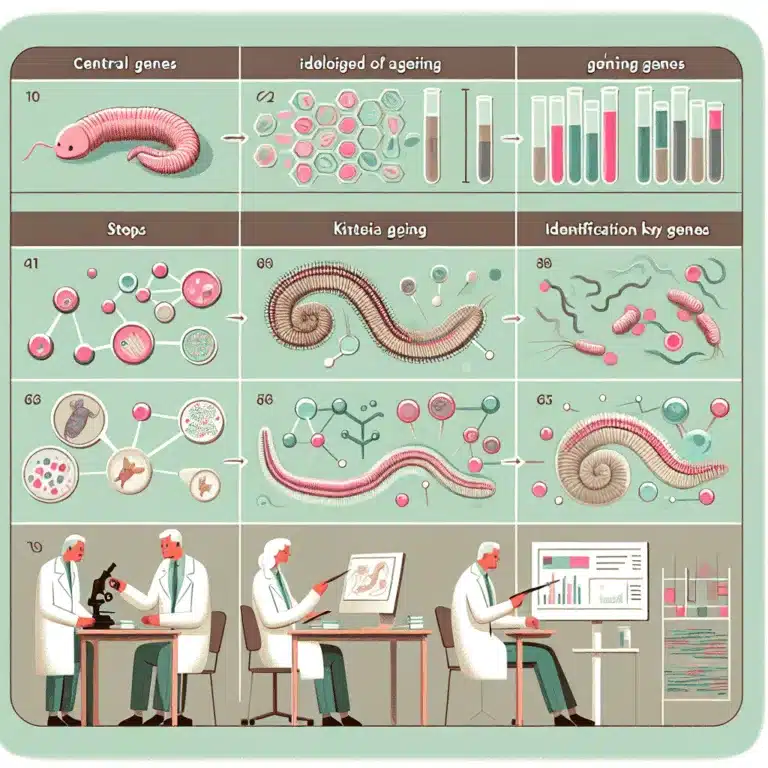
Découvrez comment des gènes centraux identifiés chez C. elegans pourraient révolutionner notre compréhension du vieillissement et ses mécanismes complexes.
Découvrez comment les macrophages pro-inflammatoires M1 influencent la régénération musculaire et le vieillissement. Un enjeu clé pour la santé musculaire !

Découvrez comment les thérapies ciblées peuvent transformer notre compréhension de l’immunité face au vieillissement et améliorer notre santé à long terme.