Impact de la Pollution Environnementale sur le Vieillissement et la Santé
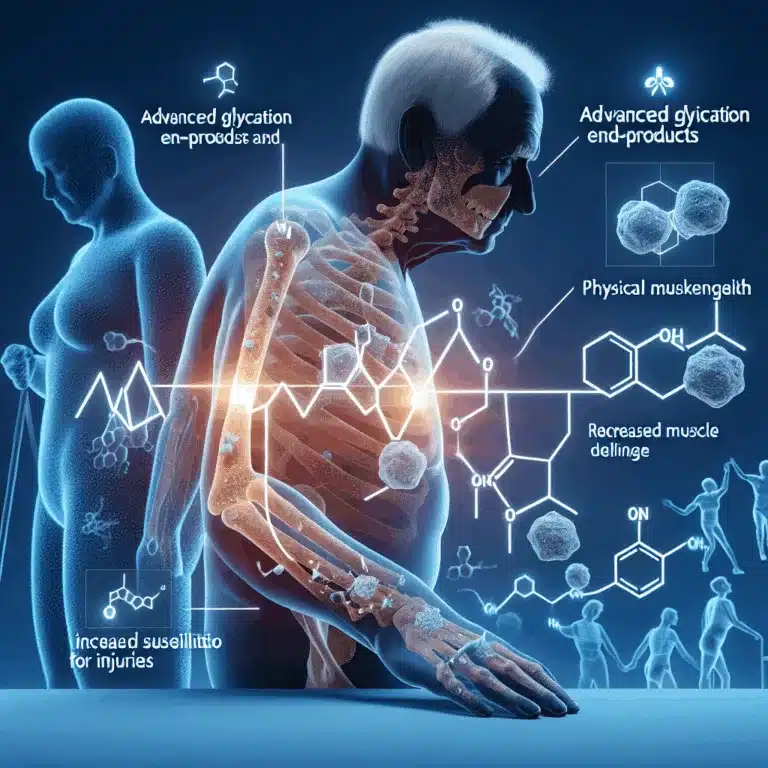
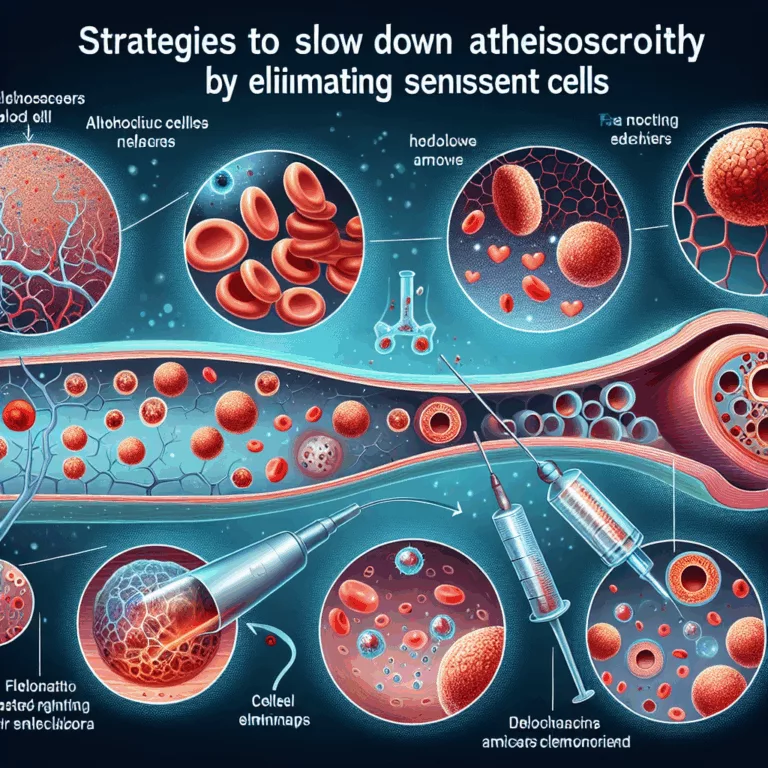
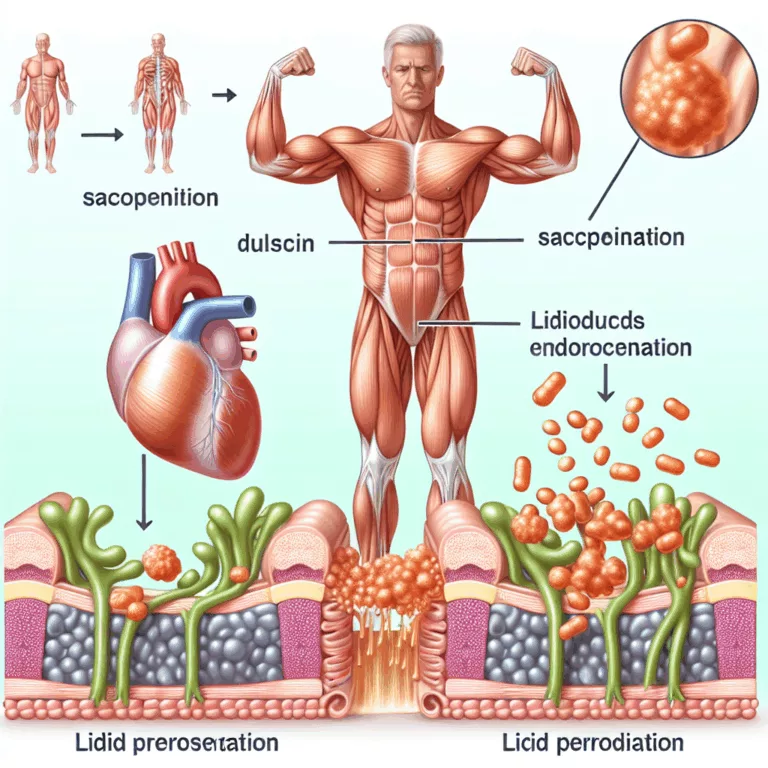
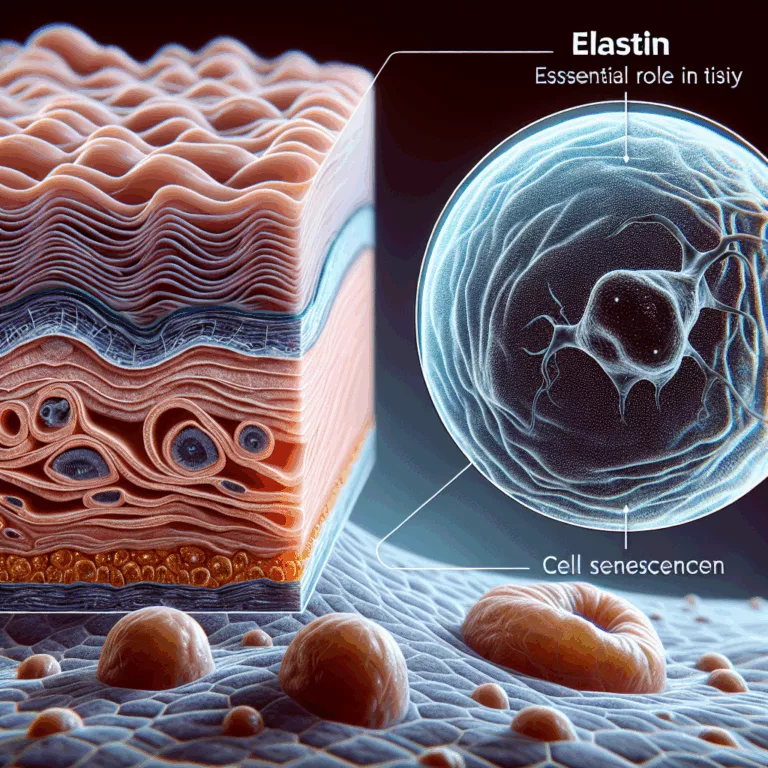
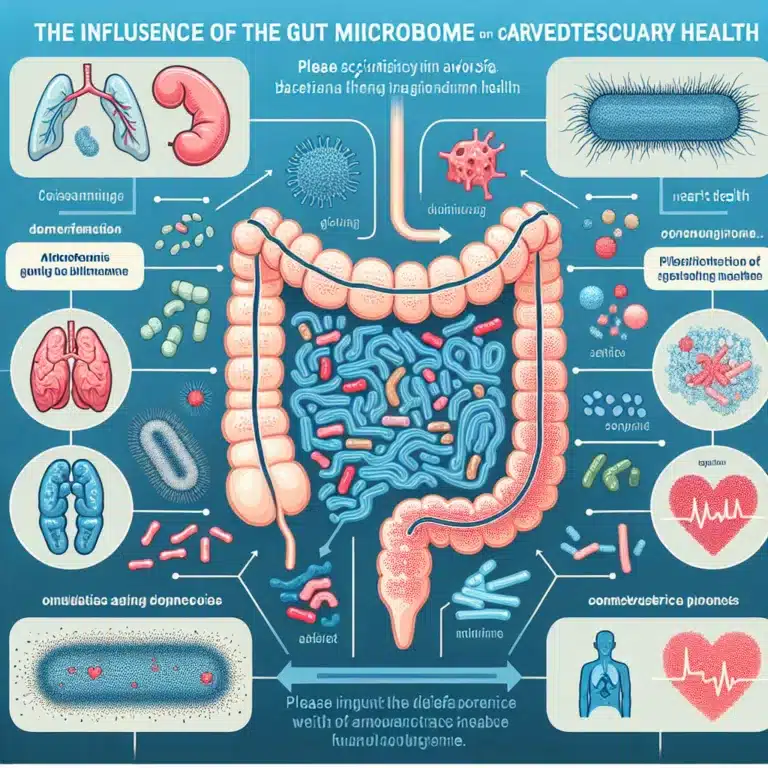
Le vieillissement primaire est lié à des mécanismes biologiques intrinsèques, tels que les processus de dégradation identifiés dans le cadre de la stratégie SENS (Strategies for Engineered Negligible Senescence). En revanche, le vieillissement secondaire est influencé par des choix de mode de vie, comme l’alimentation et l’exercice, ainsi que par des expositions environnementales, notamment la…