Comprendre la sénescence cellulaire : un marqueur clé du vieillissement humain
Découvrez comment la sénescence cellulaire influence la santé liée à l’âge et son rôle dans l’inflammation chronique.
Découvrez comment la sénescence cellulaire influence la santé liée à l’âge et son rôle dans l’inflammation chronique.
Découvrez comment l’Urolithin A améliore la fonction mitochondriale et lutte contre l’inflammation liée au vieillissement. Un atout pour votre santé !
Découvrez comment le fisetin, agent sénolytique prometteur, pourrait transformer la lutte contre la sénescence cellulaire et améliorer la fonction endothéliale.
Les cellules sénescentes s’accumulent avec l’âge dans les tissus de l’organisme, principalement lorsque les cellules atteignent la limite de Hayflick lors de la réplication, mais aussi en raison de dommages ou de stress. Le mécanisme de sénescence cellulaire Lorsqu’une cellule devient sénescente, elle cesse de se répliquer et subit des changements métaboliques profonds, ce qui…
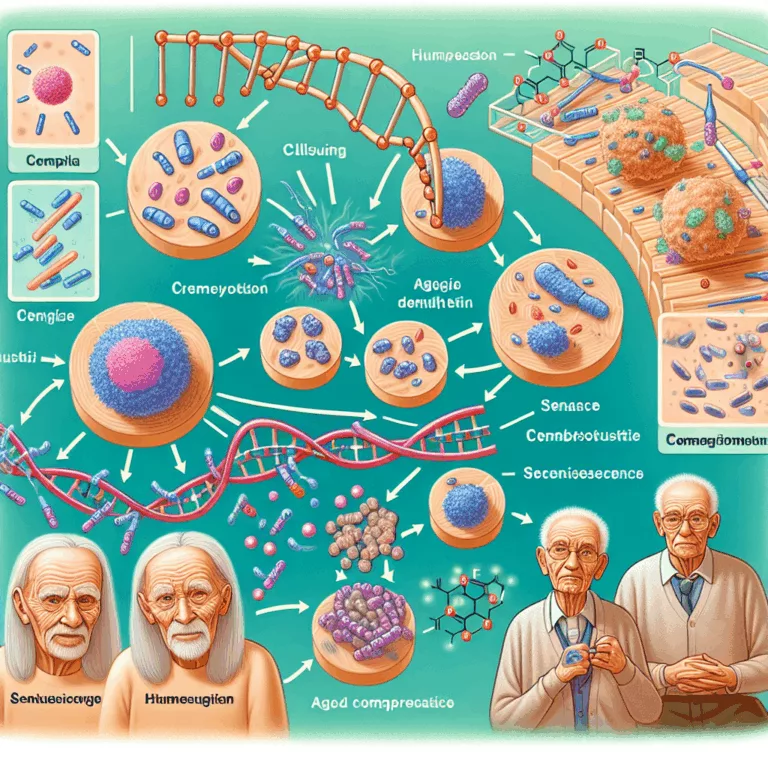
Dans l’article publié dans Aging Cell, des chercheurs ont découvert que la déméthylation de la chromatine permet une expression plus facile des composés associés au phénotype sécrétoire des cellules sénescentes (SASP). Ce phénomène est lié à des changements dans la méthylation des histones, en particulier la méthylation des lysines, qui joue un rôle crucial dans…

Les macrophages, cellules cruciales du système immunitaire inné, jouent un rôle fondamental dans le maintien et la régénération des tissus de l’organisme. Ils peuvent adopter différents comportements en fonction des circonstances, généralement divisés en macrophages M1, pro-inflammatoires et agressifs, et macrophages M2, anti-inflammatoires et axés sur la maintenance des tissus. Cette distinction est particulièrement pertinente…
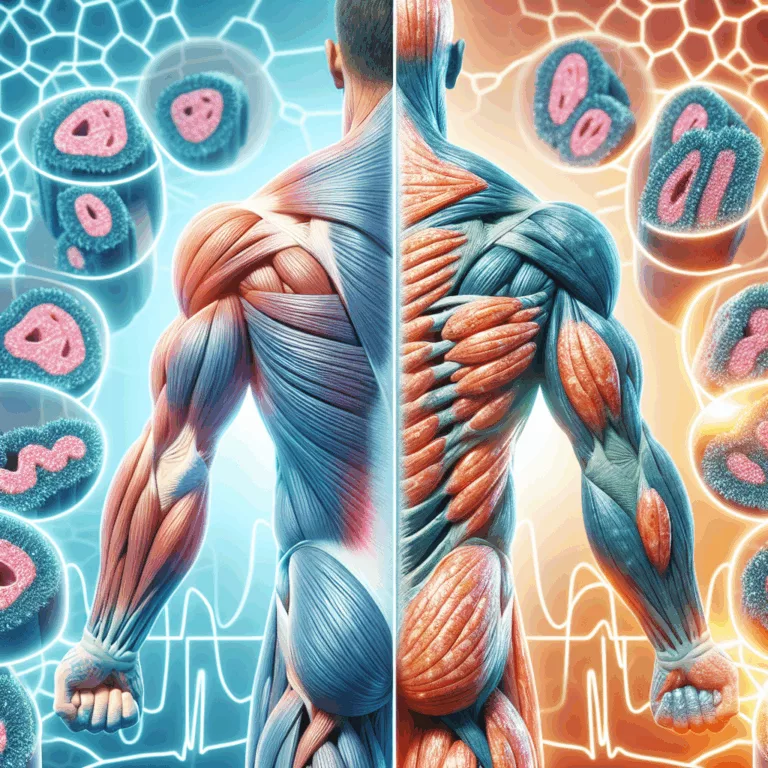
Une étude récente s’est penchée sur la sénescence dans les tissus musculaires squelettiques de souris et d’humains. Les auteurs ont démontré que le médicament antiviral maraviroc réduit la sénescence et améliore la santé musculaire chez les souris âgées. Les cellules sénescentes constituent l’un des aspects marquants du vieillissement, caractérisées par le phénotype sécrétoire associé à…
Les cellules sénescentes sécrètent des molécules signal qui peuvent inciter d’autres cellules à devenir également sénescentes, ce qui entraîne une accumulation néfaste dans les tissus vieillissants. Cette accumulation de cellules sénescentes a des effets délétères tant sur la structure que sur la fonction des tissus. La communauté de recherche a étudié les différents composants du…
Les cellules sénescentes s’accumulent dans le corps vieillissant, générant un mélange puissant de signaux pro-inflammatoires connu sous le nom de phénotype sécrétoire associé à la sénescence (SASP), qui perturbe la structure et la fonction des tissus. Au cours de la dernière décennie, les chercheurs ont consacré de plus en plus de temps et d’efforts à…

La lutte contre le cancer implique des traitements tels que la chimiothérapie et la radiothérapie, qui visent non seulement à tuer les cellules cancéreuses, mais aussi à induire la sénescence dans celles qui survivent. La sénescence cellulaire, caractérisée par l’incapacité des cellules à se reproduire, est considérée comme un résultat bénéfique, bien qu’une compréhension plus…