Stimulation Électrique et Modulation des Macrophages pour la Régénération Tissulaire
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
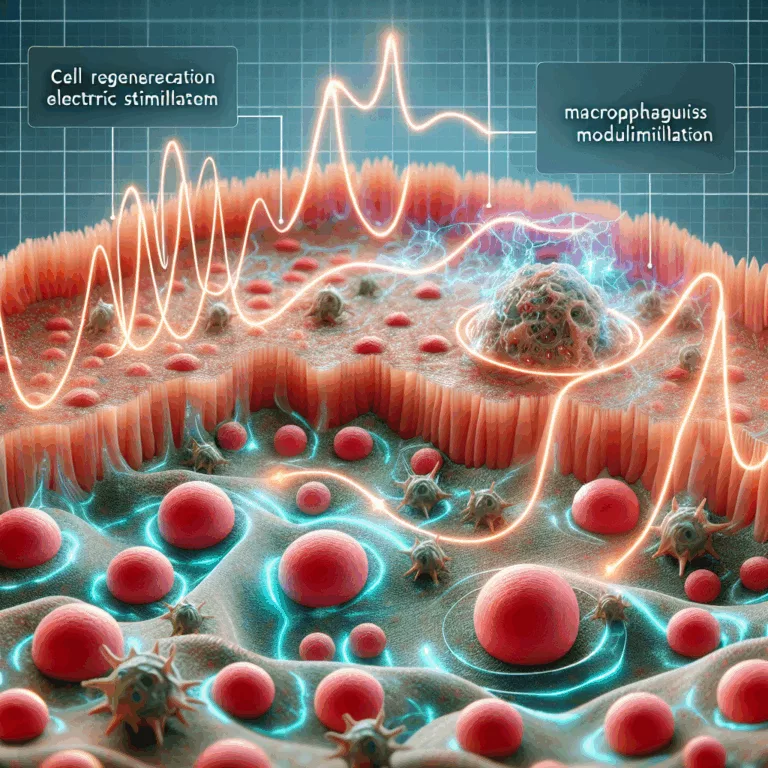
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.

Une étude récente publiée dans le Journal of Pharmacology and Experimental Therapeutics présente une stratégie thérapeutique innovante visant à réparer les dommages tissulaires causés par des maladies inflammatoires chroniques et dégénératives, notamment l’arthrite rhumatoïde (RA) et la fibrose, grâce à l’inhibition du complexe I mitochondrial. Conduite par la société Istesso, spécialisée dans la réparation tissulaire,…
Les chercheurs rapportent une avancée dans la compréhension de la biochimie des interactions pathologiques entre les types cellulaires dans le contexte de la démence vasculaire (VaD). En cartographiant les niveaux d’expression génique dans les tissus vasculaires sains et malades, ils ont identifié une base thérapeutique potentielle dans un ensemble spécifique de niveaux d’expression altérés observés…
La perte progressive du sens de l’odorat est un aspect du vieillissement qui est souvent négligé, bien qu’elle puisse être liée à des dommages cellulaires et tissulaires, ce qui la considère comme une forme de neurodégénérescence. Cette condition touche plus de 12 % de la population et son incidence augmente avec l’âge. Elle peut être…

La recherche sur la relation entre la peau et le cerveau présente un intérêt particulier, même si le développement de thérapies basées sur ces découvertes semble complexe. L’article en accès libre décrit comment les vésicules extracellulaires produites par des cellules cérébrales peuvent influencer le comportement des cellules de la peau, offrant ainsi une possibilité de…

Les scientifiques ont récemment identifié une protéine de surface associée à la sénescence, ciblable par des anticorps. Cette découverte pourrait aider à distinguer entre les cellules sénescentes bénéfiques et nuisibles, et accélérer le développement de thérapies sénolytiques. Le travail a été réalisé par le Lifespan Research Institute, issu de la fusion de la SENS Research…
L’appréciation croissante du rôle des cellules de soutien, en particulier des astrocytes, dans la progression des conditions neurodégénératives, est au cœur des recherches récentes. Pendant plus d’un siècle, les astrocytes ont été considérés comme de simples cellules de soutien pour les neurones. Cependant, des études récentes ont révélé que ces cellules ne sont pas homogènes,…