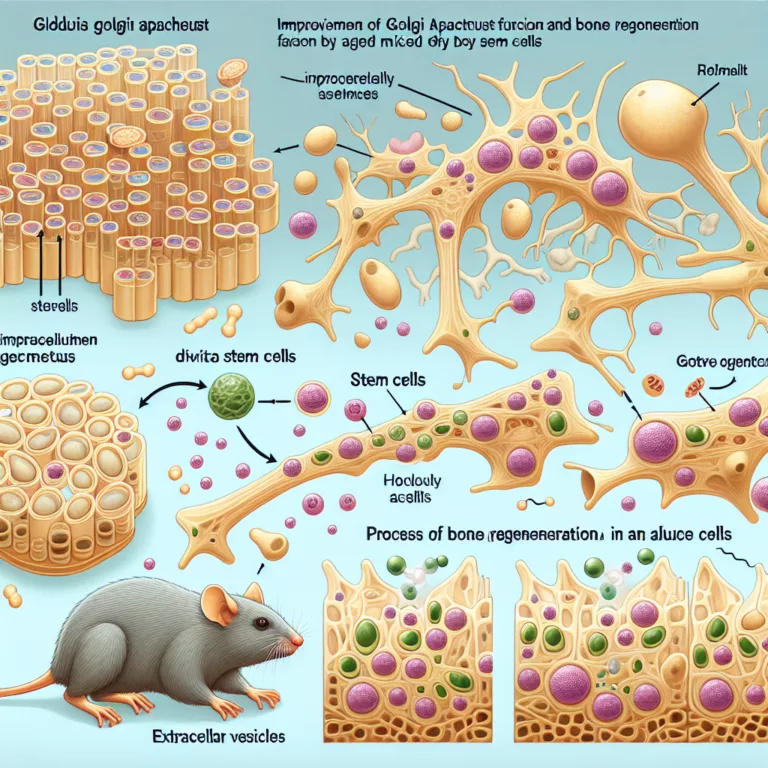
Amélioration de la fonction de l’appareil de Golgi et régénération osseuse chez les souris âgées par des vésicules extracellulaires dérivées de cellules souches
L’appareil de Golgi, bien qu’il soit souvent négligé dans les discussions sur le vieillissement, subit des dysfonctionnements comme toutes les structures cellulaires. Il joue un rôle crucial dans la direction des protéines nouvellement fabriquées vers leur destination, que ce soit à l’intérieur de la cellule ou pour être sécrétées dans des vésicules extracellulaires. Des chercheurs…