L’Hibernation Médicale : Vers un Bouton Pause pour la Médecine
Découvrez comment l’hibernation médicale pourrait offrir un nouveau paradigme dans la recherche sur la longévité et le rajeunissement.

Découvrez comment l’hibernation médicale pourrait offrir un nouveau paradigme dans la recherche sur la longévité et le rajeunissement.

Découvrez comment Telomir-1 pourrait révolutionner le traitement des maladies dégénératives grâce à ses effets sur les cellules humaines.

Découvrez comment Biostate AI et Harvard révolutionnent la recherche sur le vieillissement avec K-Dense Beta, un système IA qui accélère les découvertes biomédicales.

Découvrez le premier « Youth in Longevity Biotech Showcase » le 18 septembre 2025 : un événement virtuel présentant les talents émergents en biologie du vieillissement.
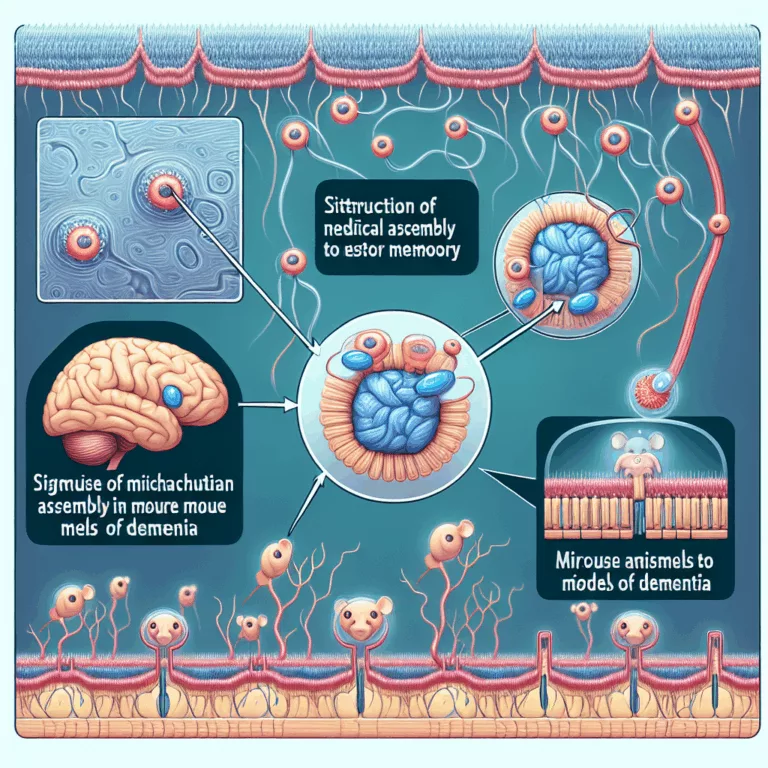
Des scientifiques ont découvert un moyen de stimuler directement l’assemblage du Complexe I dans les mitochondries, permettant de sauver des déficits de mémoire dans des modèles murins de la maladie d’Alzheimer et de la démence frontotemporale. De nombreuses maladies neurodégénératives, comme la maladie d’Alzheimer, sont associées à un dysfonctionnement mitochondrial, ce qui pourrait entraîner un…

Le principal défi auquel sont confrontées les thérapies géniques pour le traitement du vieillissement et des maladies liées à l’âge réside dans l’absence de systèmes de livraison efficaces. Actuellement, il n’existe pas de méthode bien établie pour délivrer en toute sécurité et de manière robuste une charge de taille suffisante à la plupart des organes,…

Klotho Neurosciences, une biotech axée sur la longévité, a récemment annoncé qu’elle élargissait son champ d’action au-delà de la neurologie pour explorer des technologies visant à soutenir la force musculaire, la santé osseuse et d’autres indicateurs physiologiques liés au vieillissement en bonne santé. Bien que l’entreprise continue de développer ses programmes ciblant le vieillissement cérébral…

La surdité liée à l’âge, également connue sous le nom de presbyacousie, est un problème affectant des millions de personnes dans le monde, résultant principalement de la perte des cellules ciliées sensorielles dans l’oreille interne. Ces cellules spécialisées sont essentielles pour convertir les vibrations sonores en signaux électriques destinés au cerveau. Leur perte peut être…

Le UK Biobank a récemment atteint un jalon important avec la réalisation d’une étude d’imagerie multi-organes impliquant 100 000 participants. Ce projet, qui a débuté il y a plus de dix ans, a permis la collecte de plus d’un milliard d’images médicales, intégrant des données génomiques, des biomarqueurs sanguins, des informations sur le mode de…

ScienceMachine, une startup basée à Londres, a réussi à lever 3,5 millions de dollars lors d’un tour de financement pré-seed très sollicité, dans le but d’accélérer sa mission de transformation de la recherche biomédicale grâce à l’IA autonome. La société a développé un agent d’IA autonome nommé Sam, conçu pour automatiser l’ensemble du processus d’analyse…