L’effet synergique des complexes Aβ/fibrinogène dans la progression de la maladie d’Alzheimer
Découvrez comment les complexes Aβ/fibrinogène altèrent les synapses et la barrière hémato-encéphalique dans la maladie d’Alzheimer.
Découvrez comment les complexes Aβ/fibrinogène altèrent les synapses et la barrière hémato-encéphalique dans la maladie d’Alzheimer.
Découvrez comment la régulation redox, la cystéine et les ROS influencent la durée de vie et le vieillissement cellulaire. Un mécanisme fascinant à explorer !

Avec le vieillissement, l’expression de nombreux gènes subit des modifications. Certaines de ces modifications sont adaptatives, essayant de résister à un environnement endommagé ou de compenser d’autres fonctions altérées, tandis que d’autres sont maladaptatives et causent activement des dommages. Des chercheurs ont identifié un changement maladaptatif spécifique dans l’expression des neurones du cerveau de souris…

La traduction est un processus essentiel au cours duquel les cellules fabriquent de nombreuses copies d’une protéine à partir d’une séquence d’ARNm qui encode cette protéine. Ce processus se déroule dans les ribosomes présents dans la cellule, suivis du repliement de la protéine nouvellement assemblée dans le réticulum endoplasmique. Bien que la traduction soit cruciale…
Les protéines à longue durée de vie, telles que celles présentes dans les structures des pores nucléaires, sont présentes dans certaines cellules à longue durée de vie, comme les neurones, et peuvent ne jamais être remplacées au cours de la vie normale, ou du moins avoir une longévité de plusieurs années. Cela laisse entendre que…
Après la création d’une protéine dans la cellule, celle-ci doit être repliée dans la bonne conformation pour fonctionner correctement. Un ensemble complexe de mécanismes est dédié à la fois à l’atteinte d’un repliement correct et à l’élimination des protéines mal repliées lorsque le processus échoue. La recherche sur le repliement incorrect des protéines se concentre…

L’inflammation chronique liée au vieillissement est un facteur majeur contribuant au développement et à la progression des maladies liées à l’âge. Le système immunitaire réagit de manière maladaptée aux formes de dommages moléculaires et de dysfonctionnements caractéristiques du vieillissement, entraînant des conséquences néfastes à long terme. Bien que l’inflammation à court terme soit nécessaire pour…
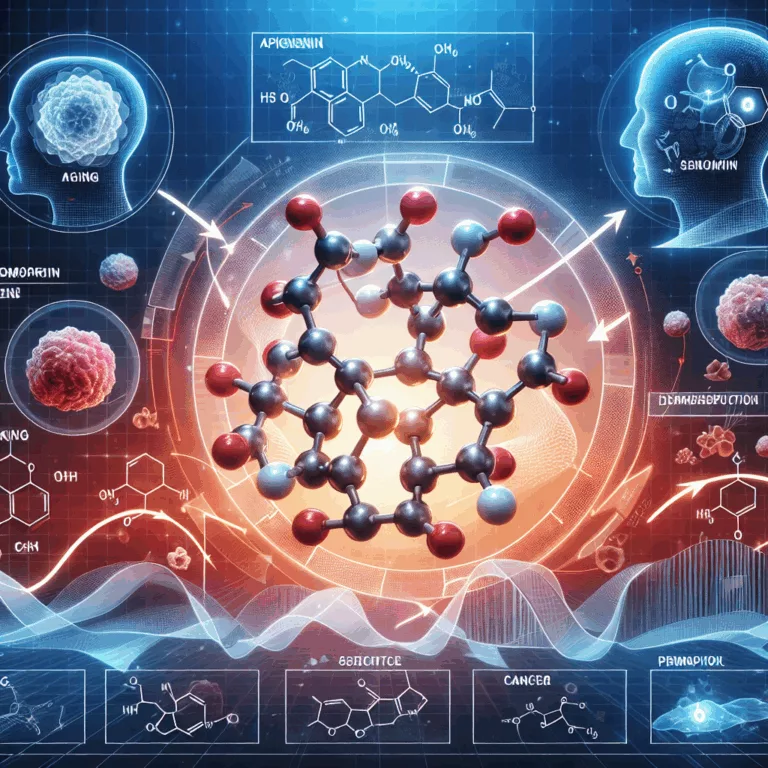
Le dépistage d’une bibliothèque de composés naturels a révélé les propriétés sénomorphiques de l’apigénine, un flavonoïde naturel. Ce composé a montré des effets de rajeunissement sur de nombreuses caractéristiques moléculaires associées au vieillissement ainsi que sur les performances physiques et cognitives, et a également un impact bénéfique sur le traitement du cancer chez les souris…
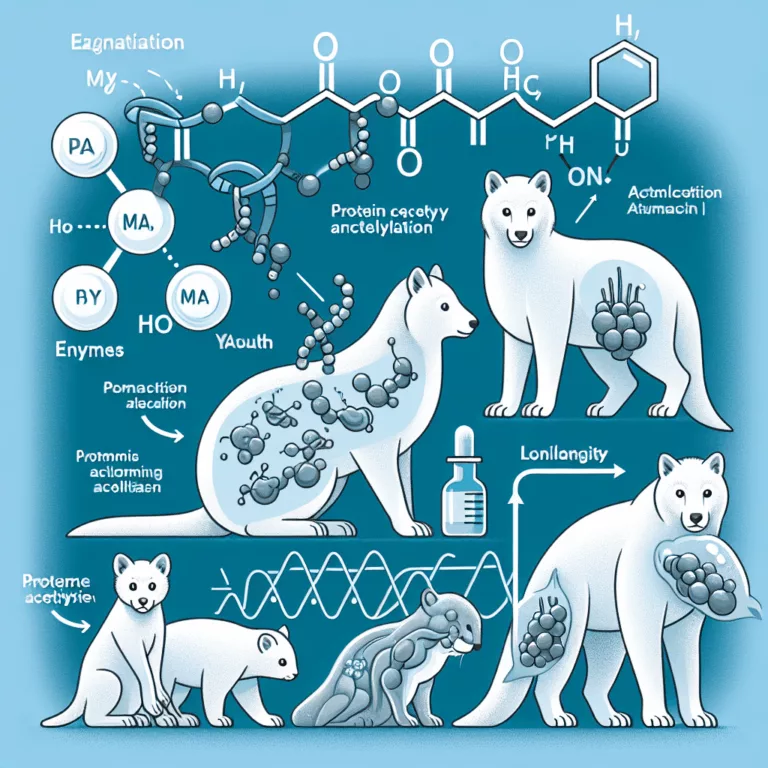
Les protéines peuvent subir un large éventail de modifications post-traductionnelles, généralement par l’ajout d’une ou plusieurs molécules. Ces modifications changent les interactions de la protéine et son rôle dans la biochimie cellulaire, ce qui fait de la modification post-traductionnelle un aspect essentiel du fonctionnement de la machinerie protéique dans la cellule. L’acétylation est l’une de…
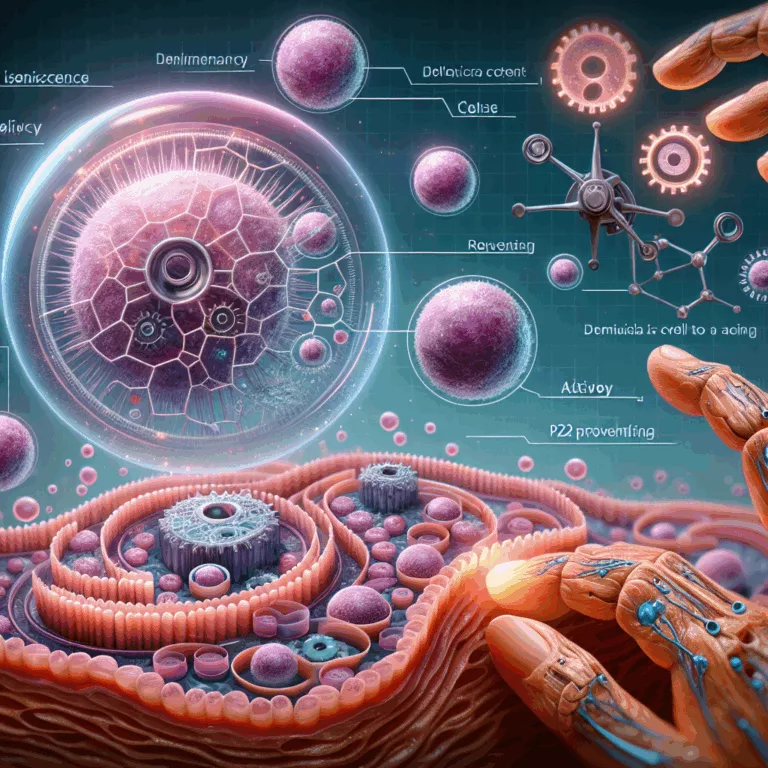
Les chercheurs ayant publié dans Aging Cell ont découvert une voie biochimique qui conduit les cellules cutanées à devenir sénescentes, ainsi qu’une cible potentielle pour des thérapies futures. Les fibroblastes dermiques, des cellules essentielles dans la recherche sur le vieillissement, jouent un rôle crucial dans le maintien de l’intégrité et du collagène de la peau….