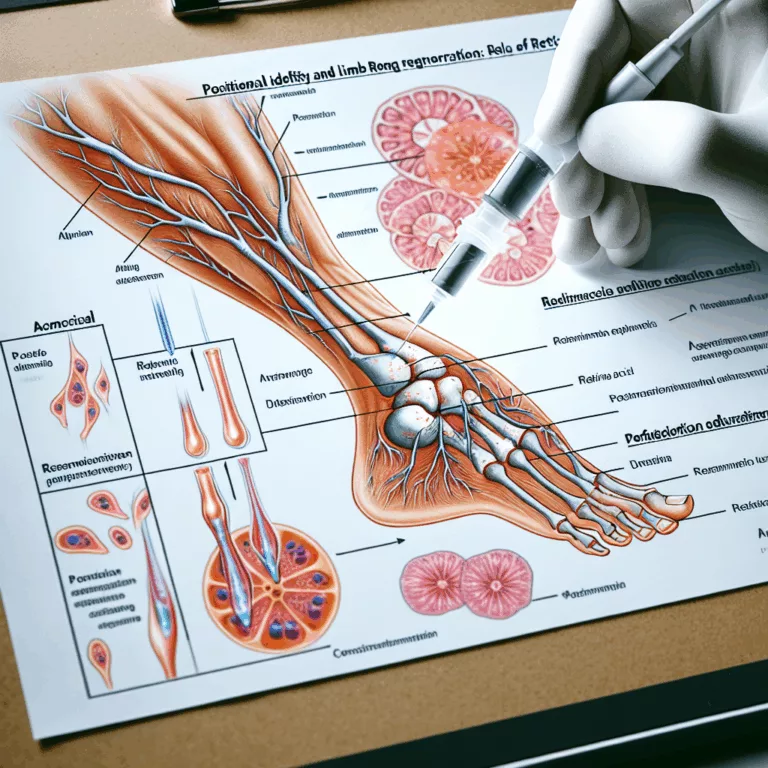
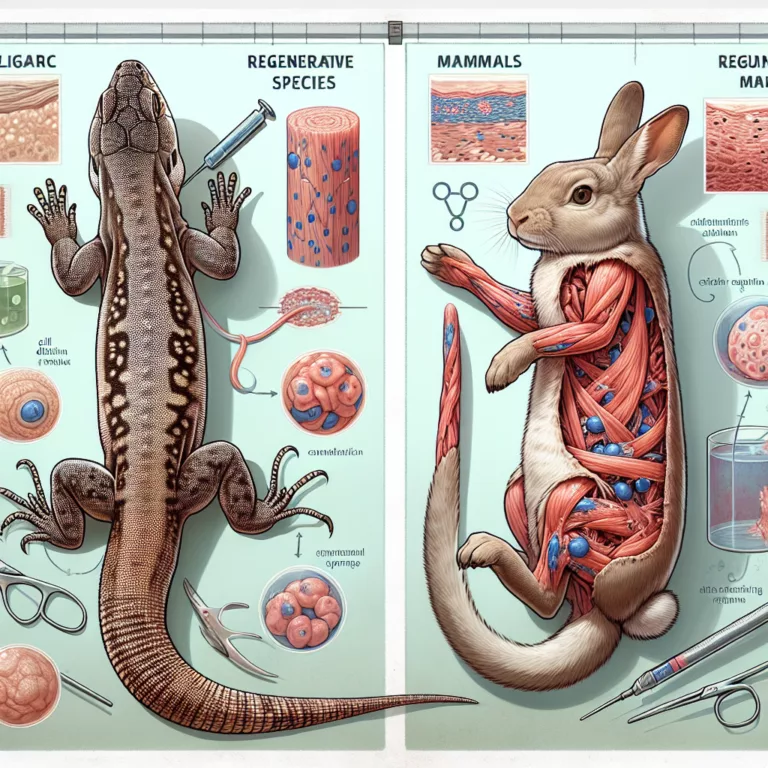
L’Identité Positionnelle et la Régénération des Membres : Rôle de l’Acide Rétinoïque
Le domaine de la biologie comparée s’intéresse principalement à la compréhension des capacités de régénération des espèces telles que les salamandres et les poissons-zèbres, afin de reproduire ces capacités chez les mammifères. Bien que des indices suggèrent que les mammifères possèdent encore les mécanismes moléculaires nécessaires à la régénération des organes, leur inactivité dans la…