Étude des Hyperintensités de la Matière Blanche et leur Impact sur le Déclin Cognitif chez les Personnes Âgées
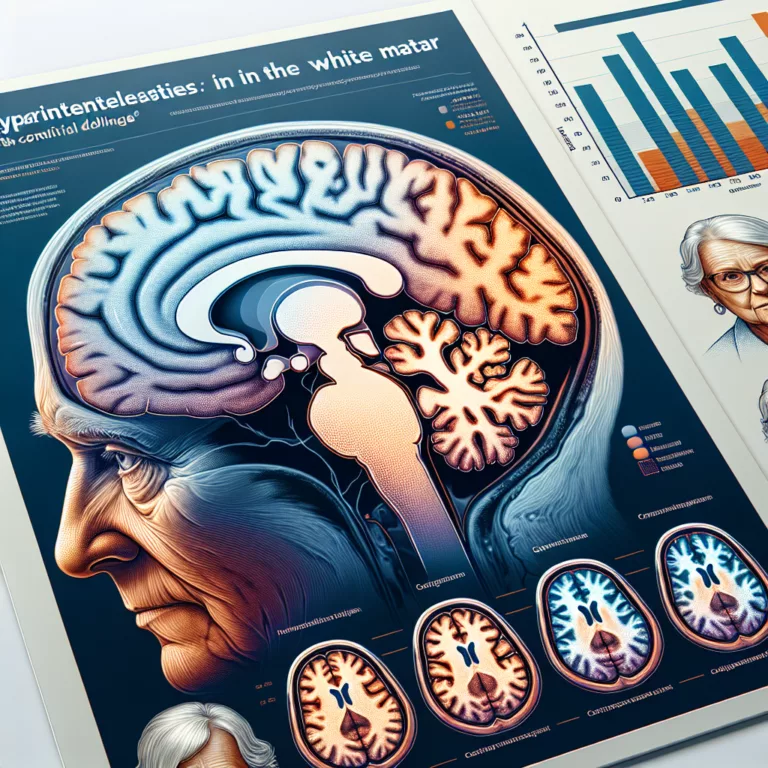
Les hyperintensités de la matière blanche (WMH) représentent de petites zones de dommages et de cicatrices dans la matière blanche du cerveau, visibles sur les images IRM. Ces lésions peuvent résulter de la rupture de petits vaisseaux sanguins ou d’autres causes localisées de mort cellulaire et d’inflammation. Une plus grande quantité de WMH est généralement…