La perte de coordination de l’expression génique comme biomarqueur du vieillissement biologique
Découvrez comment la perte de coordination de l’expression génique pourrait révéler les mécanismes secrets du vieillissement biologique.

Découvrez comment la perte de coordination de l’expression génique pourrait révéler les mécanismes secrets du vieillissement biologique.

Découvrez comment le vol spatial influence le vieillissement des cellules souches et ses implications pour la santé des astronautes et la science de la longévité.

Le texte aborde l’accumulation aléatoire des mutations dans l’ADN nucléaire, qui s’intensifie avec l’âge. Malgré l’efficacité des mécanismes de réparation de l’ADN, une partie des dommages causés par des interactions moléculaires et des radiations échappe à cette réparation, ce qui suscite des débats quant à l’impact de ces mutations sur le vieillissement dégénératif. Le consensus…
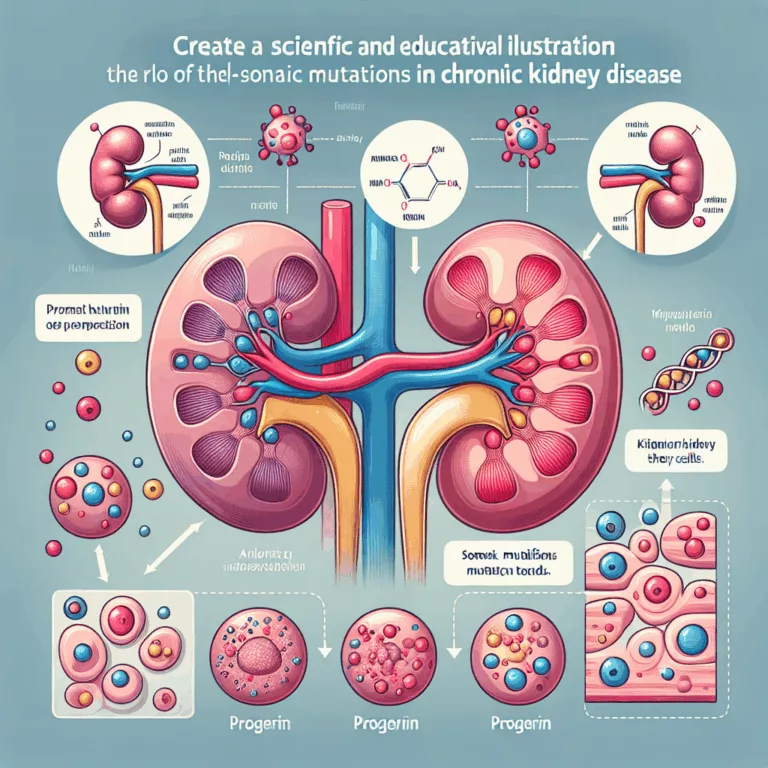
Le progerin est une forme tronquée de la protéine lamin A, essentielle pour le maintien de la structure normale du noyau cellulaire. Dans le syndrome de Hutchinson-Gilford, une mutation de lamin A entraîne une production excessive de progerin, engendrant une dysfonction cellulaire généralisée, un vieillissement accéléré et une mortalité précoce. Bien que le progerin soit…

Cette revue examine le rôle du PAI-1 (inhibiteur de l’activateur du plasminogène-1) dans le processus de vieillissement. Bien qu’un petit nombre d’individus humains présentent des mutations de perte de fonction du PAI-1, ce qui indique que les activités du PAI-1 ne sont pas vitales pour la vie, ces personnes semblent vivre en moyenne sept ans…
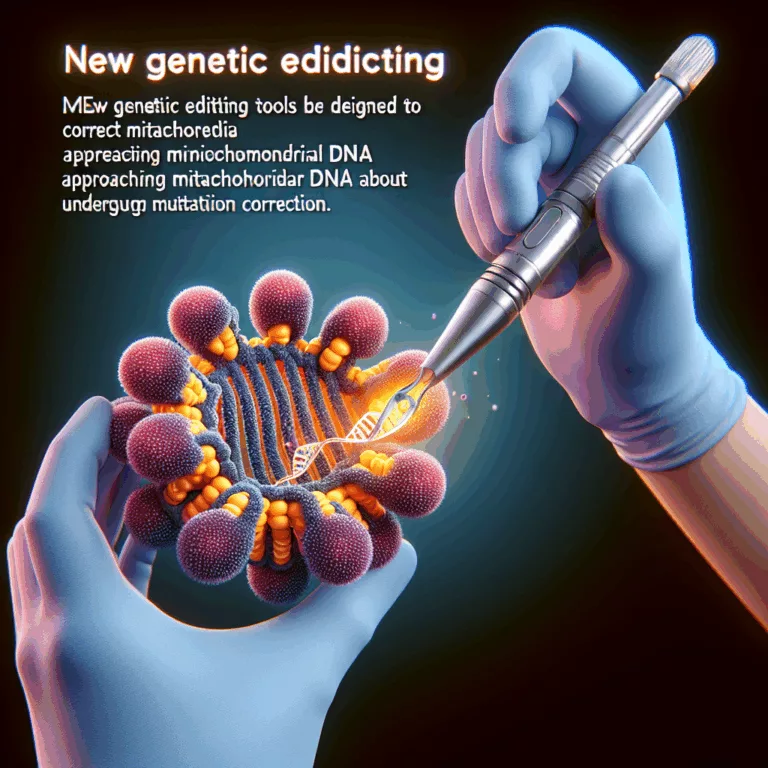
Une nouvelle étude démontre que des outils innovants d’édition génique peuvent corriger des mutations causant des maladies dans l’ADN mitochondrial des cellules humaines primaires. Les outils d’édition du génome, tels que CRISPR, ont marqué un tournant scientifique majeur, mais leur efficacité se limite à l’ADN nucléaire. Les mitochondries, qui produisent de l’énergie, possèdent leur propre…
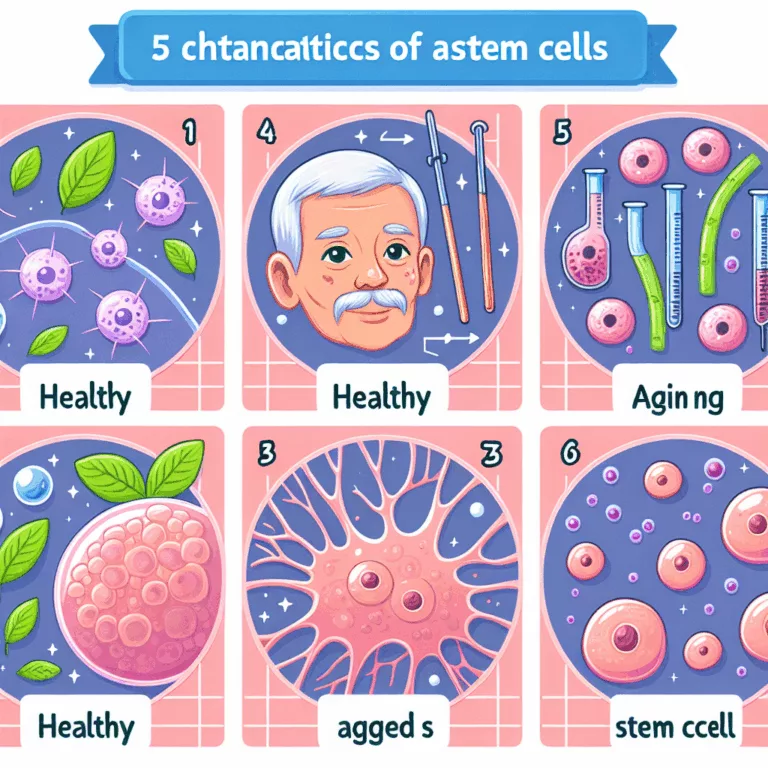
Dans une revue publiée dans la revue Cell Stem Cell, un trio de réviseurs propose cinq caractéristiques spécifiques au vieillissement des cellules souches. Contrairement à une approche axée sur les molécules, cette classification met l’accent sur les caractéristiques physiques et le comportement général des cellules souches. Les marqueurs moléculaires du vieillissement, tels que l’instabilité génomique,…
Les dommages à l’ADN sont impliqués dans le vieillissement dégénératif, bien que le débat persiste sur leur contribution précise à la dysfonction tissulaire généralisée en plus du risque accru de cancer. La plupart des dommages mutatifs à l’ADN sont rapidement réparés, tandis que la plupart des mutations durables se produisent dans des régions inutilisées du…
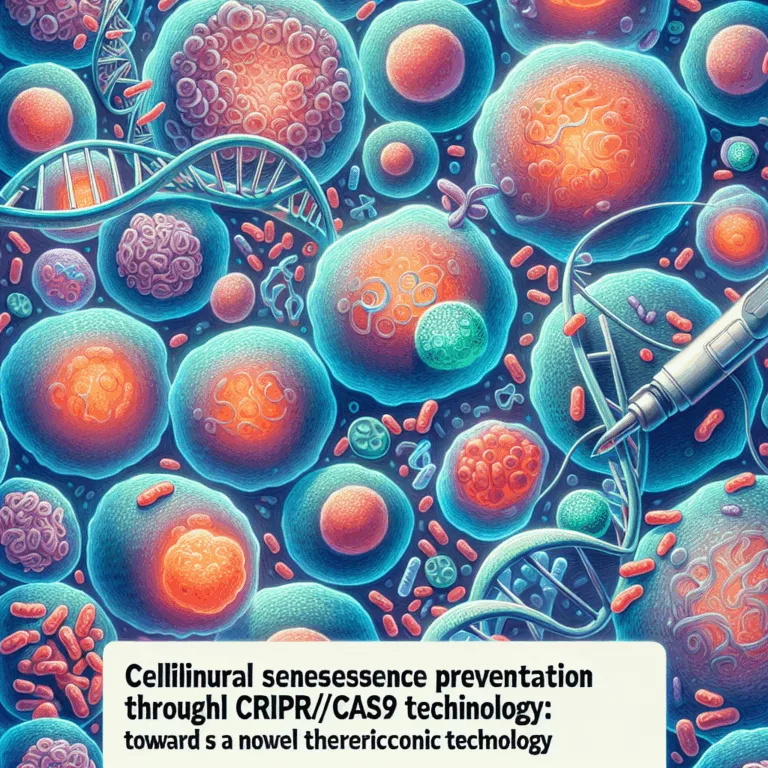
La recherche publiée dans Cell Reports Medicine explore les causes de la sénescence cellulaire induite par la technologie d’édition génique CRISPR/Cas9 et examine des méthodes potentielles pour la prévenir. L’édition génétique des cellules vivantes par CRISPR/Cas9 nécessite trois étapes : la rupture de l’ADN, l’insertion de nouveaux gènes et la réparation de l’ADN. Le processus…

Les scientifiques ont découvert que seulement 1 % des antigènes tumoraux présentés proviennent de mutations oncogéniques, tandis que les 99 % restants, souvent négligés, pourraient constituer de meilleures cibles de traitement. Le cancer résulte d’une série de mutations entraînant des comportements cellulaires anormaux, notamment une prolifération incontrôlée. Ces cellules cancéreuses affichent des peptides anormaux à…