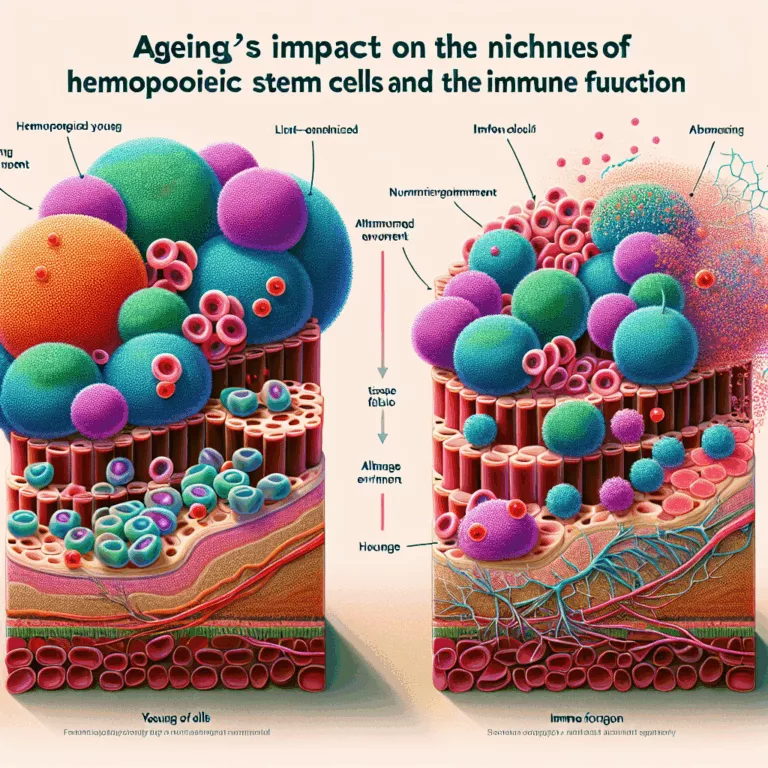
Impact du vieillissement sur les niches des cellules souches hématopoïétiques et la fonction immunitaire
Le système immunitaire subit une diminution de son efficacité avec l’âge, en grande partie à cause de la dégradation des cellules souches hématopoïétiques présentes dans la moelle osseuse. Ces cellules sont essentielles pour la production de cellules immunitaires, mais elles deviennent progressivement endommagées et dysfonctionnelles. Ce déclin n’affecte pas seulement les cellules souches elles-mêmes, mais…