L’Influence du BDNF sur la Santé Cognitive des Personnes Âgées
Découvrez comment le BDNF influence la fonction cognitive et son rôle potentiel dans le déclin cognitif des personnes âgées.

Découvrez comment le BDNF influence la fonction cognitive et son rôle potentiel dans le déclin cognitif des personnes âgées.
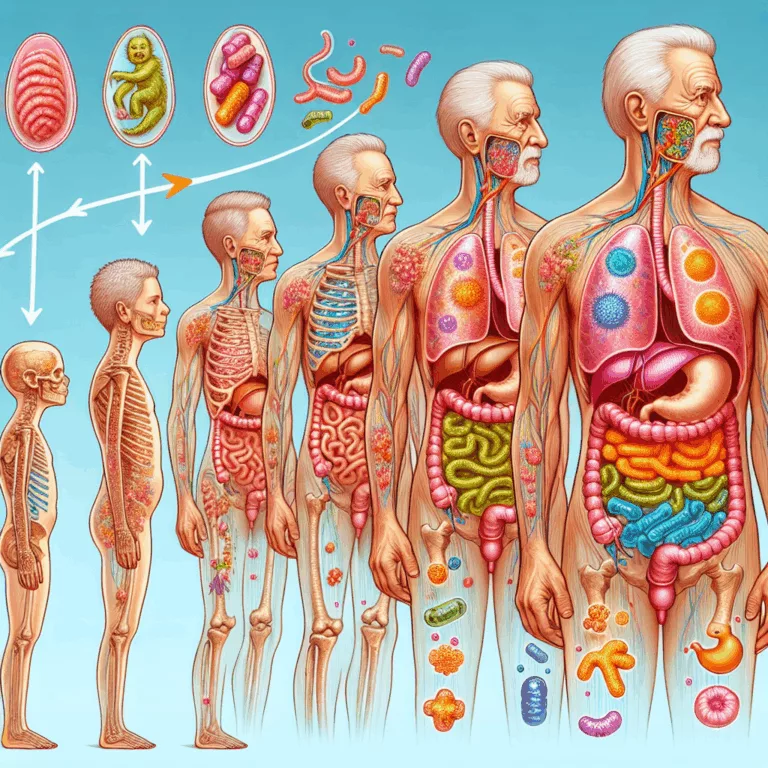
Découvrez comment le microbiome intestinal influence la santé et le vieillissement, et les innovations prometteuses dans ce domaine crucial.

Découvrez comment la recherche sur la longévité lutte contre le vieillissement et les maladies liées à l’âge. Explorez des avancées fascinantes dès maintenant !
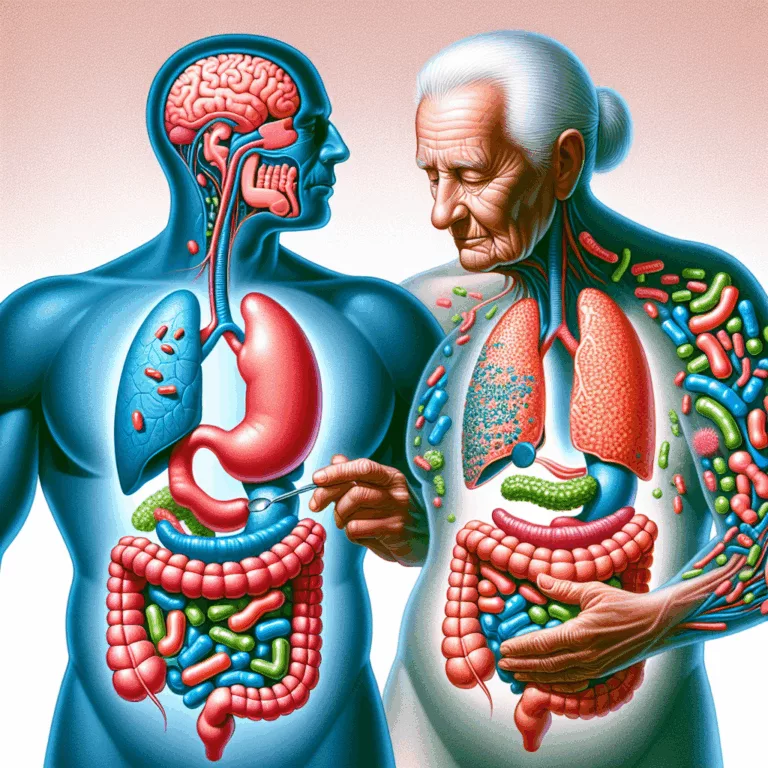
Découvrez comment le microbiome intestinal influence le vieillissement et les maladies liées à l’âge. Une clé pour une santé optimale ?

Découvrez comment les thérapies ciblées peuvent transformer notre compréhension de l’immunité face au vieillissement et améliorer notre santé à long terme.
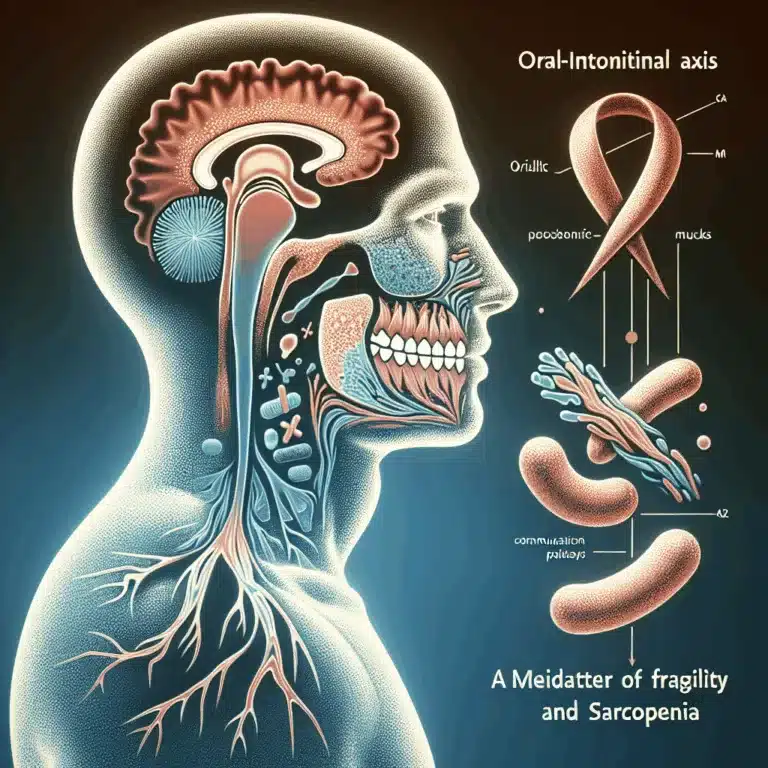
Le microbiome intestinal a suscité un grand intérêt ces dernières années, grâce à la possibilité d’évaluer de manière précise et économique sa composition par le séquençage de l’ARN ribosomal 16S. Les recherches montrent que la composition du microbiome intestinal évolue avec l’âge, favorisant des espèces générant une inflammation chronique au détriment de celles produisant des…
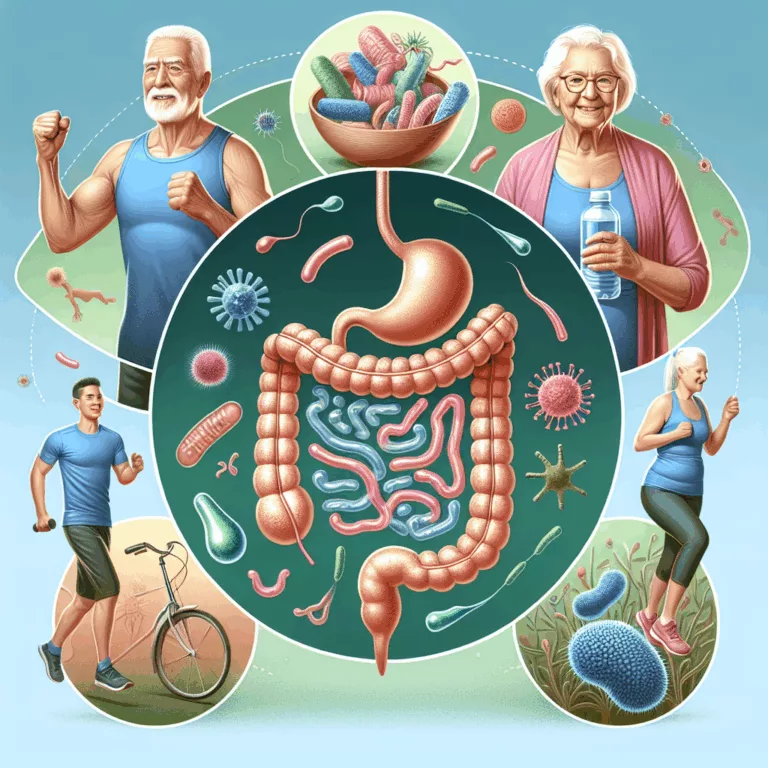
La recherche sur le microbiome intestinal suscite un intérêt croissant, notamment en ce qui concerne son rôle dans le vieillissement dégénératif et les variations naturelles de la durée de vie humaine. Des études ont été menées sur la composition des microbiomes intestinaux chez des individus très âgés, tels que les centenaires. Une étude transversale réalisée…

Fight Aging! est une plateforme qui publie des nouvelles et des commentaires sur la lutte contre les maladies liées à l’âge, en cherchant à contrôler les mécanismes de vieillissement grâce à la médecine moderne. Le bulletin d’information hebdomadaire est envoyé à des milliers d’abonnés. Le fondateur de Fight Aging!, Reason, propose également des services de…
Ces dernières années, la recherche a mis en évidence l’influence de la composition du microbiome intestinal sur la santé à long terme ainsi que sur le vieillissement et les affections liées à l’âge. Des études ont établi des corrélations entre des espèces microbiennes spécifiques et des conditions de santé, montrant que l’ajustement de l’équilibre des…

Cette étude met en lumière le rôle d’un métabolite produit par des microbes intestinaux, le 10-hydroxy-cis-12-octadécenoïque (10-HSA), dans la promotion de la réparation des tissus de l’intestin et du foie. Les chercheurs explorent les mécanismes par lesquels certaines configurations du microbiome intestinal favorisent la santé, avec l’espoir de découvrir d’autres éléments similaires. Dans cette recherche,…