Rajeunissement cognitif : Comment des exercices numériques peuvent inverser le vieillissement du cerveau
Une étude de McGill révèle que des exercices numériques peuvent restaurer la chimie cérébrale liée à la mémoire à des niveaux de jeunesse.

Une étude de McGill révèle que des exercices numériques peuvent restaurer la chimie cérébrale liée à la mémoire à des niveaux de jeunesse.

Aviv Clinics a annoncé une nouvelle étude de cohorte rétrospective démontrant que la thérapie à l’oxygène hyperbare (HBOT) peut améliorer de manière significative les résultats cognitifs chez les adultes ayant subi un traumatisme crânien (TBI) durant l’enfance et continuant à éprouver un syndrome post-commotionnel (PCS). Cette recherche a été réalisée par le Sagol Center for…
Une nouvelle étude publiée dans la revue Nature Aging a mis en évidence le rôle d’une protéine associée au fer, FTL1, dans le déclin cognitif lié à l’âge. Les chercheurs de l’UC San Francisco ont identifié FTL1 comme un facteur pro-vieillissement dans l’hippocampe, une région du cerveau cruciale pour l’apprentissage et la mémoire. Ils ont…

Une nouvelle recherche de l’École de Médecine de Harvard et de ses collaborateurs révèle que la déplétion naturelle en lithium dans le cerveau précède les symptômes de la maladie d’Alzheimer et pourrait offrir une voie thérapeutique sûre pour la prévention et le traitement. Traditionnellement associé à la psychiatrie et au traitement du trouble bipolaire, le…
La neurogenèse, ou la création de nouveaux neurones dans le cerveau, est un processus bien établi chez les souris adultes, mais il reste des doutes quant à sa présence chez les humains adultes. Bien que le consensus général suggère que les humains ne diffèrent pas des souris à cet égard, établir que la neurogenèse se…
Les microglies sont des cellules immunitaires innées du cerveau, comparables aux macrophages dans le reste du corps. Des recherches récentes montrent que le comportement inflammatoire maladaptatif des microglies dans le cerveau vieillissant joue un rôle crucial dans l’apparition et la progression de maladies neurodégénératives comme la maladie d’Alzheimer. Certaines microglies deviennent inflammatoires en réponse à…
TDP-43, ou TAR DNA-binding protein 43, est une protéine qui peut se modifier pour former des agrégats solides, contribuant ainsi à l’apparition et à la progression de diverses conditions neurodégénératives. Cette pathologie cérébrale a été récemment identifiée, notamment avec la définition de l’encéphalopathie TDP-43 liée à l’âge (LATE), qui fait partie des maladies neurodégénératives. TDP-43…
Les astrocytes réactifs dans le tissu cérébral sont des cellules qui deviennent inflammatoires en réponse à l’environnement local. Ce phénomène devient particulièrement fréquent avec l’âge, à cause de divers types de dommages moléculaires caractéristiques du vieillissement, tels qu’une signalisation inflammatoire accrue provenant d’autres cellules, y compris les cellules sénescentes, et l’accumulation de déchets métaboliques dans…

Le reprogrammation cellulaire complète se produit dans les premiers stades de l’embryon, entraînée par l’expression des facteurs de Yamanaka, souvent abrégés en OSKM. Ce processus transforme les cellules germinales adultes en cellules souches embryonnaires, réinitialisant les motifs épigénétiques et restaurant la fonction mitochondriale. Les chercheurs ont réussi à reproduire ce processus pour produire des cellules…
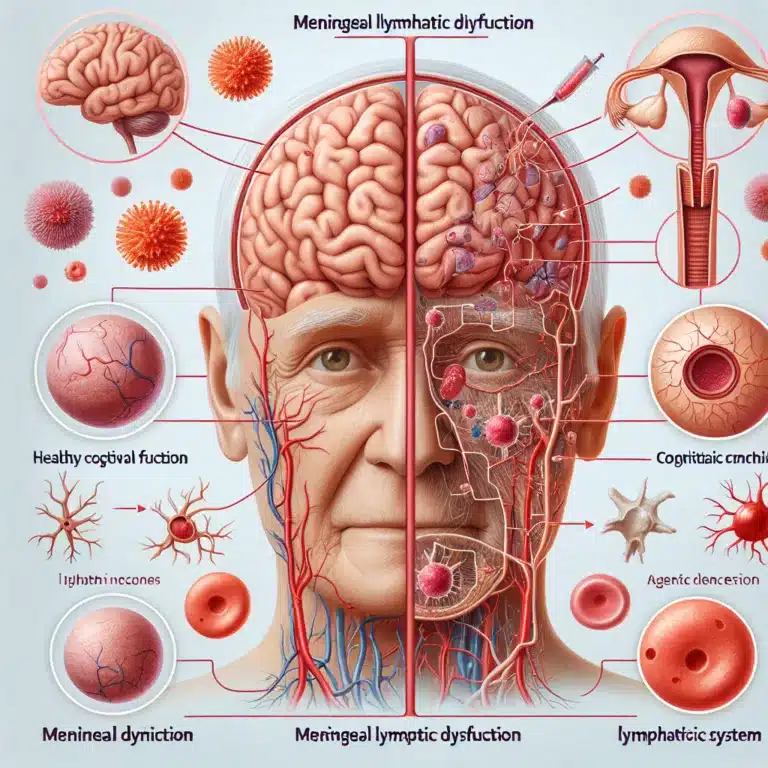
Le liquide céphalorachidien (LCR) est produit en permanence, circule dans le cerveau et s’évacue dans le corps. Ce flux transporte les déchets métaboliques du cerveau, et les chercheurs commencent à considérer l’altération liée à l’âge de l’évacuation du LCR comme une contribution significative à la perte de fonction cognitive et au développement de conditions neurodégénératives…