Lésion cérébrale traumatique et risque accru de maladie d’Alzheimer : le rôle de la vasculature cérébrale
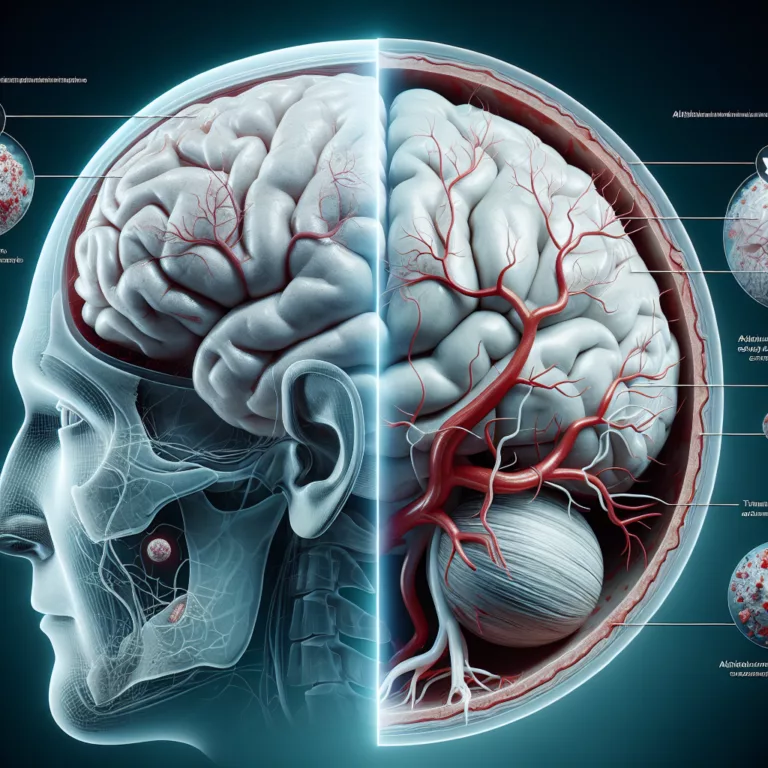
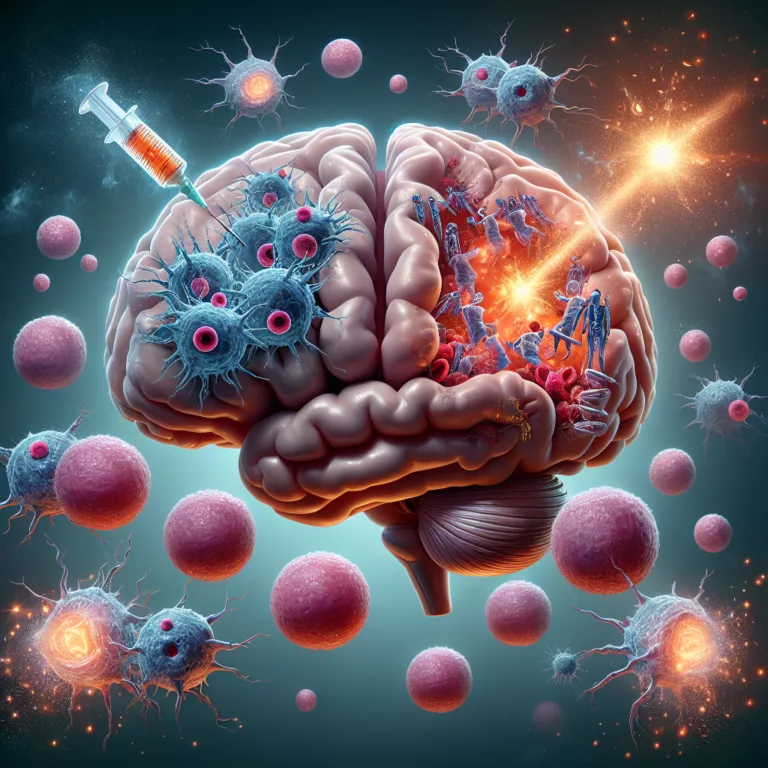
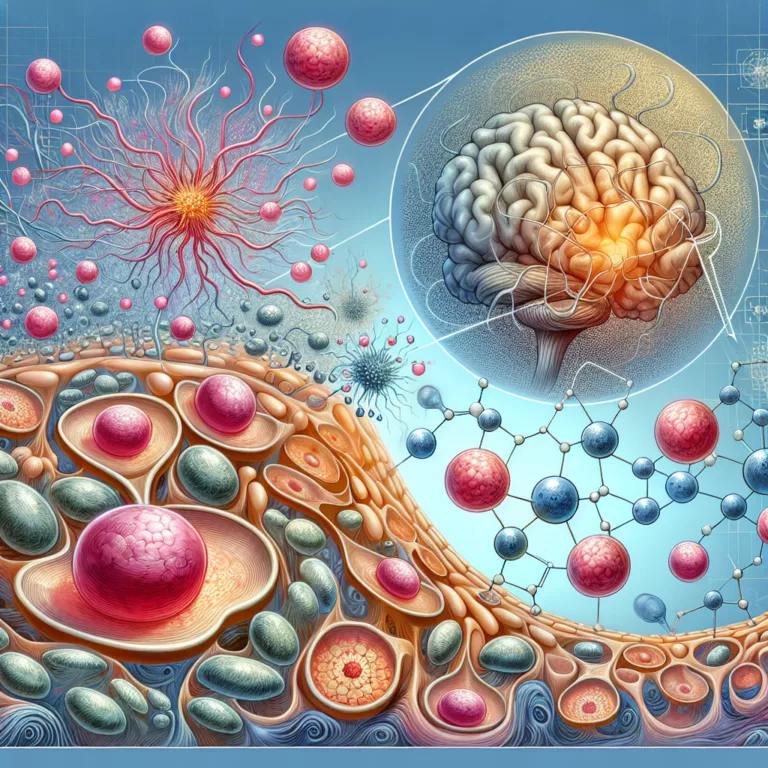
Les survivants d’une lésion cérébrale traumatique (TBI) présentent un risque accru de développer la maladie d’Alzheimer en raison de changements spécifiques dans la vasculature du cerveau blessé. Ces modifications semblent accélérer la déposition d’amyloïde-β, soutenant l’hypothèse de la cascade amyloïde, qui postule que l’agrégation d’amyloïde-β constitue la pathologie fondamentale de la maladie d’Alzheimer. Les lésions…