Le rôle des macrophages sénescents dans l’évolution des tumeurs : un équilibre délicat
Découvrez comment les macrophages sénescents influencent la croissance tumorale et l’évasion immunitaire dans le microenvironnement tumoral.

Découvrez comment les macrophages sénescents influencent la croissance tumorale et l’évasion immunitaire dans le microenvironnement tumoral.
Découvrez comment les macrophages pro-inflammatoires M1 influencent la régénération musculaire et le vieillissement. Un enjeu clé pour la santé musculaire !
Découvrez comment les sous-types de macrophages influencent le vieillissement et l’obésité, révélant des liens surprenants entre inflammation et régénération.
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
Les cellules immunitaires innées, notamment les monocytes et les macrophages, jouent un rôle crucial dans le fonctionnement des tissus corporels. Avec l’âge, ces cellules peuvent devenir dysfonctionnelles, notamment en devenant plus inflammatoires. Contrairement à d’autres parties du corps, le cerveau possède sa propre population de cellules similaires, appelées microglies. Il est donc intéressant de noter…
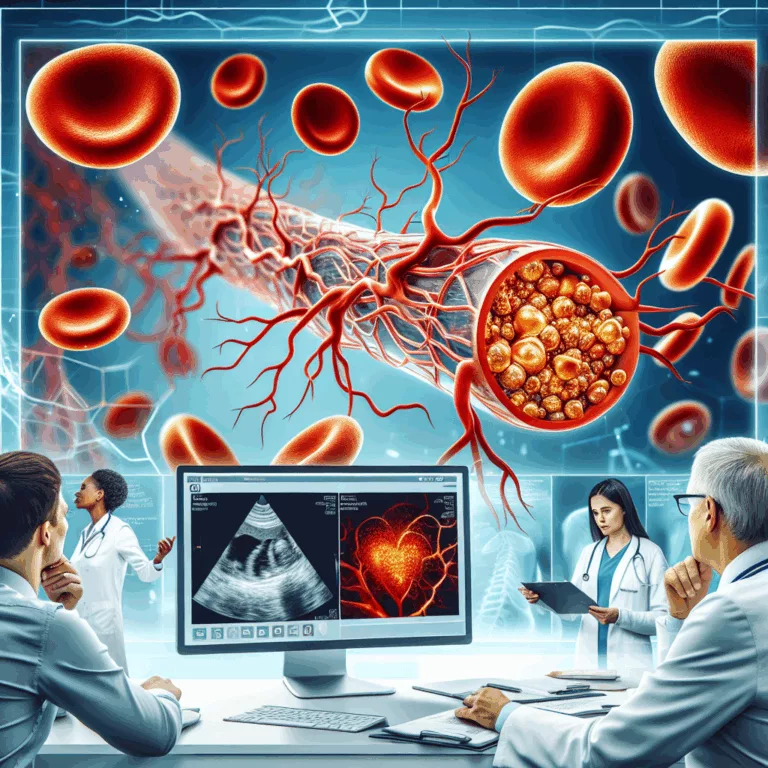
La recherche sur l’athérosclérose est cruciale car cette maladie cardiovasculaire est l’une des principales causes de mortalité dans le monde, résultant de l’accumulation de plaques dans les artères. Un article récent de Cyclarity Therapeutics présente le médicament UDP-003, qui vise à traiter la cause profonde de l’athérosclérose plutôt que de se concentrer uniquement sur ses…

Fight Aging! est une plateforme qui traite de l’actualité et des commentaires en lien avec la lutte contre les maladies liées à l’âge, visant à maîtriser les mécanismes de vieillissement grâce à la médecine moderne. Le bulletin hebdomadaire est envoyé à des milliers d’abonnés intéressés par ces thématiques. Les services de consultation stratégique sont offerts…

Les macrophages, cellules cruciales du système immunitaire inné, jouent un rôle fondamental dans le maintien et la régénération des tissus de l’organisme. Ils peuvent adopter différents comportements en fonction des circonstances, généralement divisés en macrophages M1, pro-inflammatoires et agressifs, et macrophages M2, anti-inflammatoires et axés sur la maintenance des tissus. Cette distinction est particulièrement pertinente…
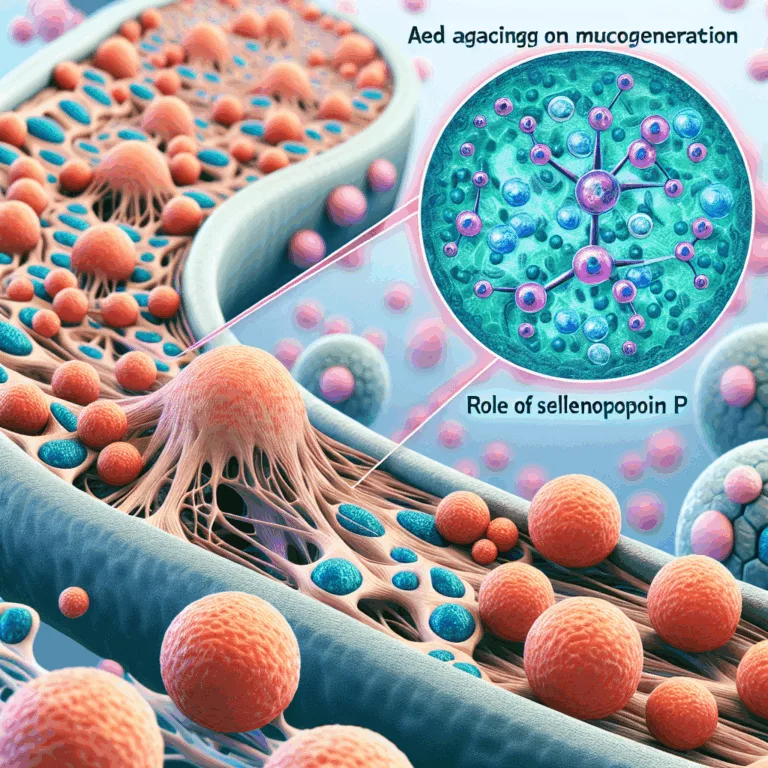
Le vieillissement a un impact négatif sur la régénération musculaire pour des raisons qui ne sont pas complètement comprises. Cette incompréhension découle en partie du fait que la régénération musculaire implique un ensemble complexe d’interactions entre différents types de cellules, dont les comportements évoluent au fil du temps en réponse aux blessures. Il est bien…

Le site Fight Aging! se consacre à la publication de nouvelles et de commentaires sur les recherches visant à éliminer les maladies liées à l’âge par le contrôle des mécanismes du vieillissement grâce aux avancées de la médecine moderne. Le bulletin hebdomadaire est envoyé à des milliers d’abonnés intéressés par la longévité et les innovations…