L’Impact de l’Activité Physique sur la Restriction Calorique : Nouvelles Perspectives
Découvrez comment l’activité physique influence les bénéfices de la restriction calorique sur la santé et la longévité des individus.

Découvrez comment l’activité physique influence les bénéfices de la restriction calorique sur la santé et la longévité des individus.
Le texte aborde le rôle des cellules sénescentes dans l’inflammation chronique de l’âge et leur impact sur la structure et le fonctionnement des tissus. Il souligne que l’accumulation de cellules sénescentes est exacerbée par un excès de tissu adipeux viscéral, qui perturbe également le métabolisme et contribue à l’inflammation chronique. Bien que les cellules sénescentes…
La recherche a considéré le rôle de la dysrégulation du métabolisme de l’insuline dans le développement de la maladie d’Alzheimer, suggérant même qu’elle pourrait être classée comme un diabète de type 3. Bien que les données épidémiologiques montrent que la maladie d’Alzheimer n’est pas aussi clairement une conséquence directe et fiable de l’obésité et des…
La désaccouplement mitochondrial est un processus par lequel les mitochondries des cellules passent de la production de l’adénosine triphosphate (ATP), une molécule de stockage d’énergie chimique, à la libération de cette énergie sous forme de chaleur. Ce phénomène suscite un intérêt particulier dans le contexte du vieillissement, car une régulation à la hausse du désaccouplement…
Les activités et les interactions de l’insuline, de l’hormone de croissance et du facteur de croissance analogue à l’insuline 1 (IGF-1) sont parmi les influences les mieux étudiées sur le rythme du vieillissement chez les modèles animaux. Il a été démontré que la signalisation IGF-1 altérée ralentit le vieillissement et prolonge la vie, en affectant…

Juvena Therapeutics, une entreprise de biotechnologie axée sur la longévité, a lancé son premier essai clinique humain pour sa thérapie biologique phare, JUV-161, conçue pour régénérer le tissu musculaire. Ce traitement, appelé ‘insuline pour les muscles’, a montré son efficacité dans des modèles précliniques en favorisant la formation des fibres musculaires, en inversant l’atrophie musculaire,…
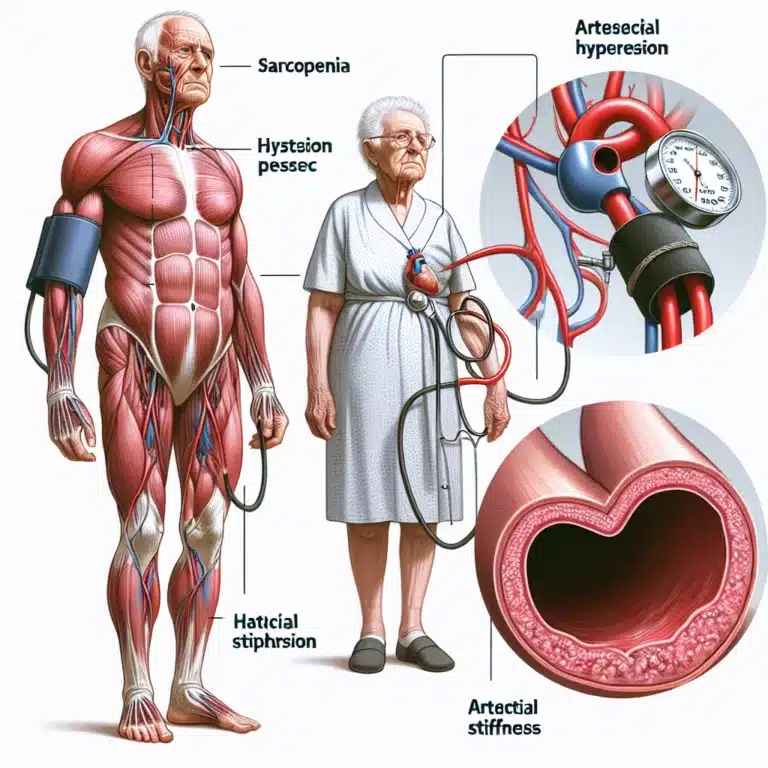
Ce texte aborde les relations complexes entre la sarcopénie, l’hypertension et la rigidité artérielle chez les personnes âgées, en explorant comment ces conditions peuvent interagir et s’influencer mutuellement. La sarcopénie, définie comme la perte de masse musculaire et de force liée à l’âge, est examinée dans le cadre d’une étude transversale impliquant 2 237 adultes…
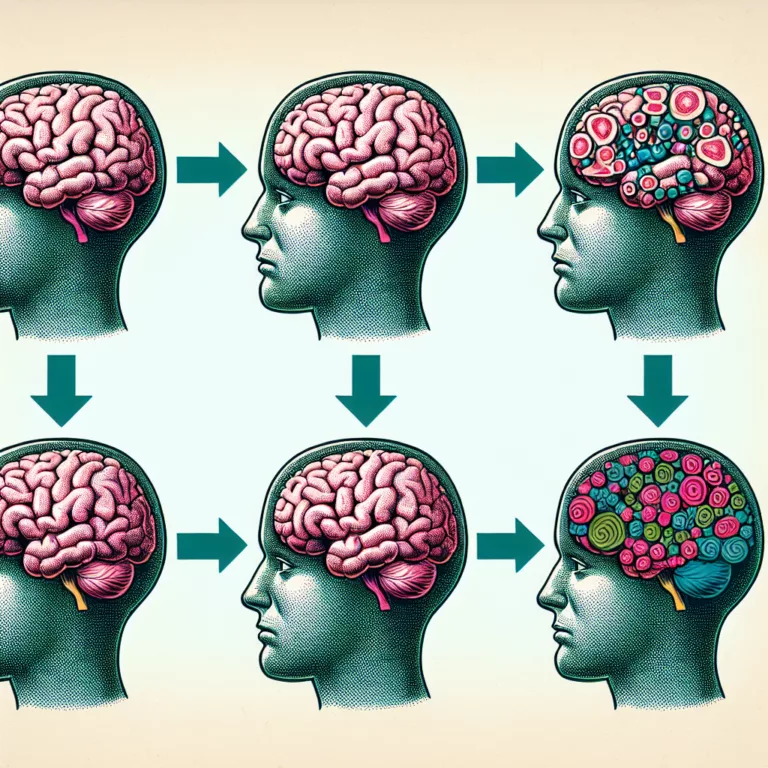
Une nouvelle étude publiée dans Nature Metabolism suggère qu’une courte période de consommation d’aliments sucrés et gras peut entraîner des changements cérébraux similaires à ceux observés dans l’obésité et le diabète de type 2. Cette étude, réalisée par l’Hôpital Universitaire de Tübingen, le Centre Allemand de Recherche sur le Diabète et Helmholtz Munich, a recruté…
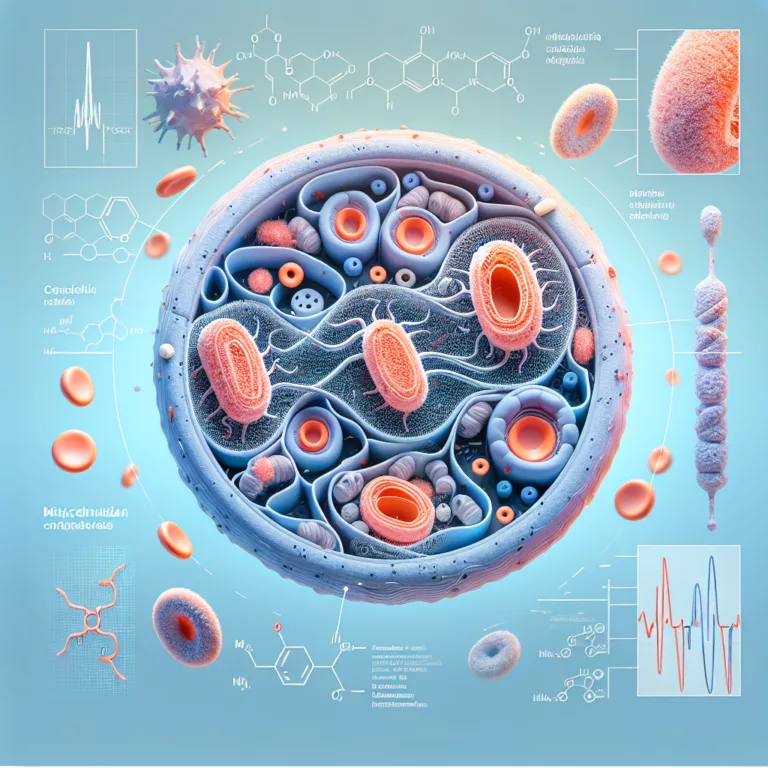
Une nouvelle étude révèle que les mitochondries endommagées activent la réponse au stress intégrée, ce qui entraîne une perte d’identité et un dysfonctionnement des cellules β pancréatiques, ainsi que des cellules hépatiques et adipeuses. En bloquant cette réponse, des bénéfices ont été observés dans des modèles murins. Le lien entre mitochondries et diabète de type…
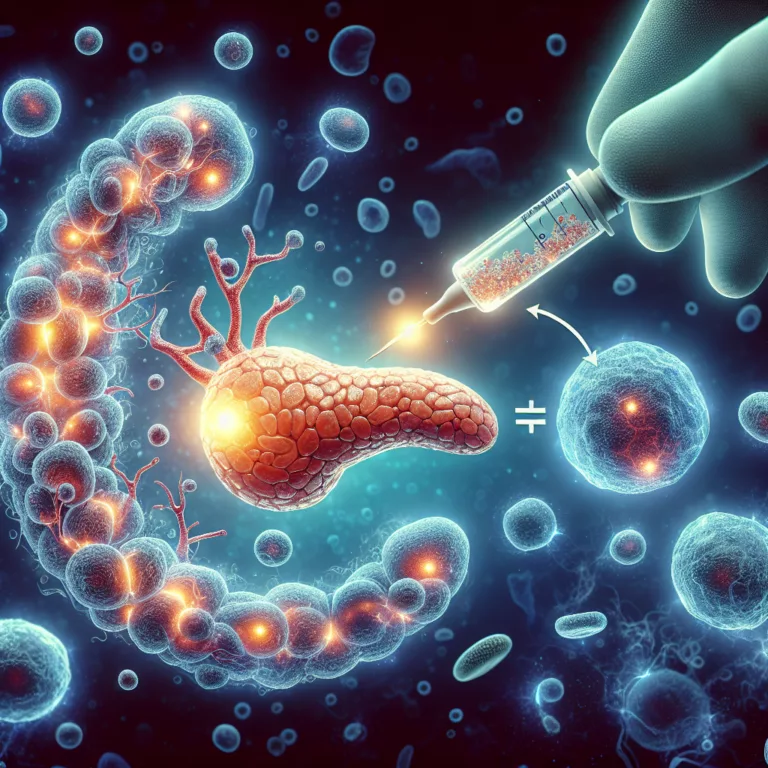
Dans une étude publiée dans *Cell Reports Medicine*, des chercheurs ont réussi à créer un pancréas fonctionnel à partir de cellules humaines, qui a montré son efficacité chez des souris. Cette recherche se concentre sur les défis des injections d’insuline pour traiter le diabète de type 1, en soulignant que le suivi constant et les…