La Lutte Contre le Vieillissement : Mécanismes, Innovations et Implications
Découvrez comment la médecine moderne pourrait transformer notre compréhension du vieillissement et de la longévité.

Découvrez comment la médecine moderne pourrait transformer notre compréhension du vieillissement et de la longévité.
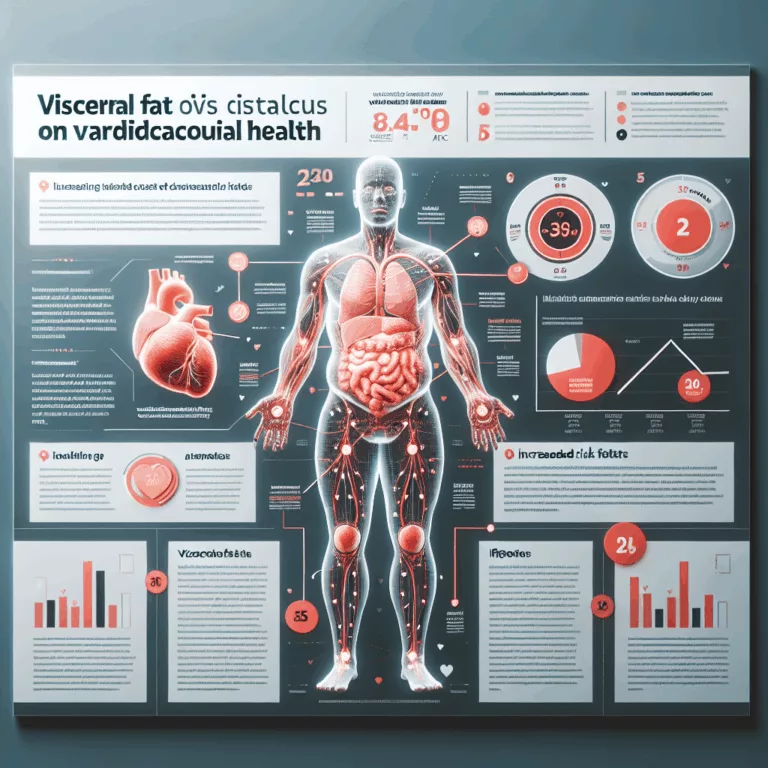
Découvrez comment le gras viscéral influence l’athérosclérose et les maladies cardiaques, selon une étude récente sur la santé artérielle.
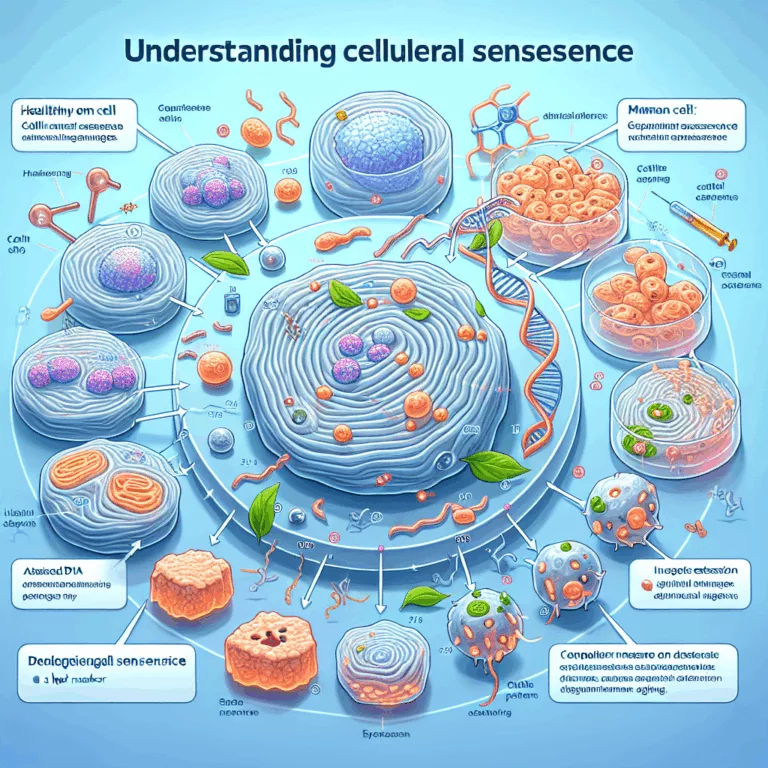
Découvrez comment la sénescence cellulaire influence la santé liée à l’âge et son rôle dans l’inflammation chronique.
Découvrez comment STING, une protéine clé, pourrait transformer le traitement de l’inflammation chronique et des maladies neurodégénératives.

Découvrez comment des approches pharmacologiques pourraient inverser la perte musculaire liée à l’âge, complétant l’exercice physique traditionnel.
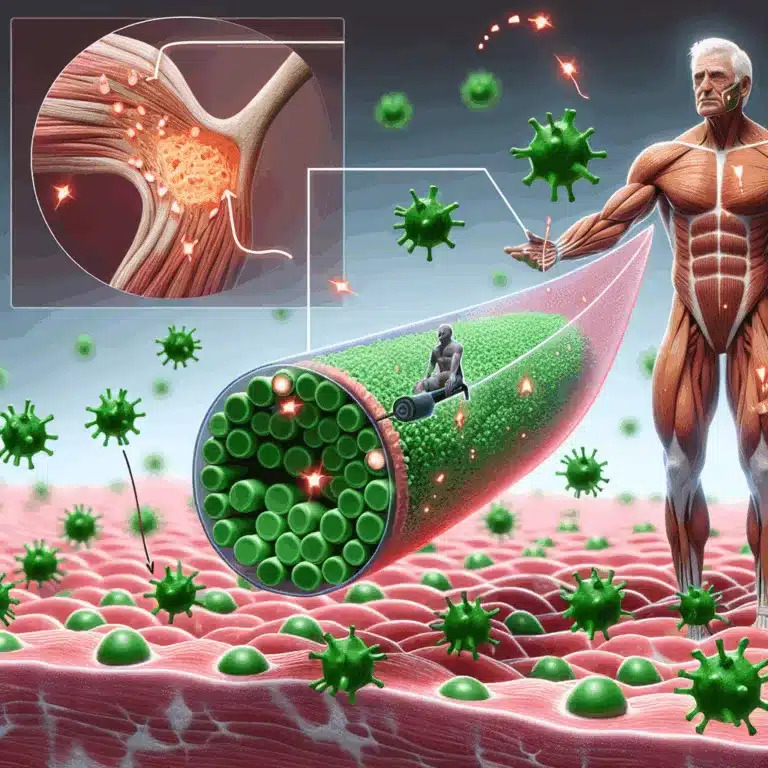
Découvrez comment l’épigallocatéchine gallate, délivrée de manière ciblée, pourrait révolutionner le traitement de la dysfonction musculaire liée à l’âge.

Découvrez comment la recherche sur la longévité lutte contre le vieillissement et les maladies liées à l’âge. Explorez des avancées fascinantes dès maintenant !
Découvrez comment l’excès de tissu adipeux influence la progression de la maladie d’Alzheimer et son lien avec l’inflammation et la neurodégénérescence.
Les cellules sénescentes s’accumulent avec l’âge dans les tissus de l’organisme, principalement lorsque les cellules atteignent la limite de Hayflick lors de la réplication, mais aussi en raison de dommages ou de stress. Le mécanisme de sénescence cellulaire Lorsqu’une cellule devient sénescente, elle cesse de se répliquer et subit des changements métaboliques profonds, ce qui…

Introduction Les maladies cardiovasculaires (MCV) et la démence représentent deux des défis de santé mondiaux les plus pressants, en particulier dans les pays à revenu faible et intermédiaire. Des études épidémiologiques démontrent une forte corrélation entre l’incidence des MCV et celle de la démence. Cette relation suggère qu’il existe un mécanisme causal possible, comme la…