La Lutte Contre le Vieillissement : Mécanismes, Innovations et Implications
Découvrez comment la médecine moderne pourrait transformer notre compréhension du vieillissement et de la longévité.

Découvrez comment la médecine moderne pourrait transformer notre compréhension du vieillissement et de la longévité.
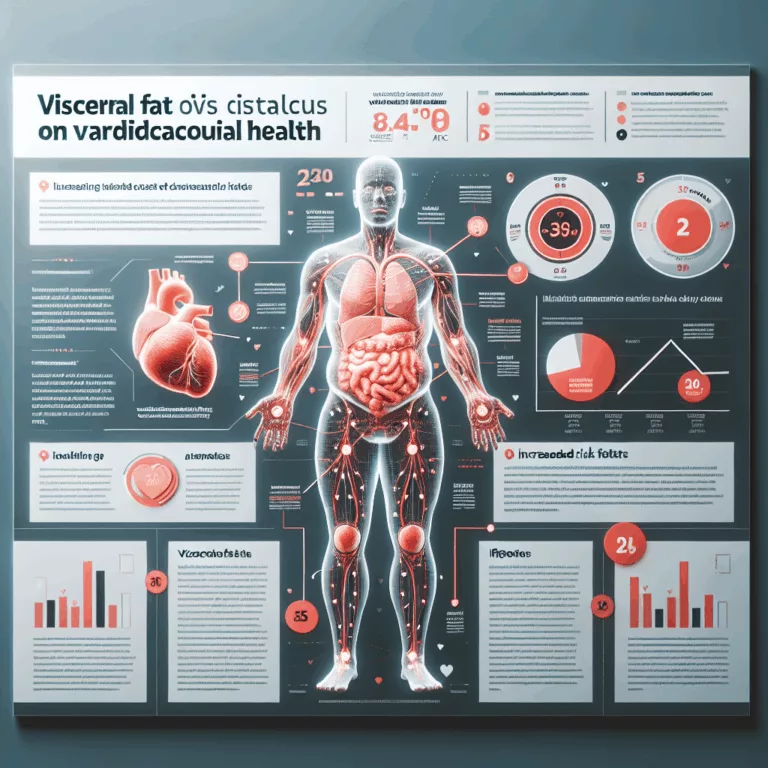
Découvrez comment le gras viscéral influence l’athérosclérose et les maladies cardiaques, selon une étude récente sur la santé artérielle.

Découvrez comment le tissu adipeux et le TMAO influencent la santé à mesure que nous vieillissons, révélant des mécanismes sous-jacents à l’inflammation.

Découvrez les résultats décevants du traitement latozinemab d’Alector et son impact sur la recherche en démence frontotemporale.
Découvrez comment Elevara Medicines innove avec une thérapie ciblant les fibroblastes pour traiter l’arthrite rhumatoïde et d’autres maladies inflammatoires.
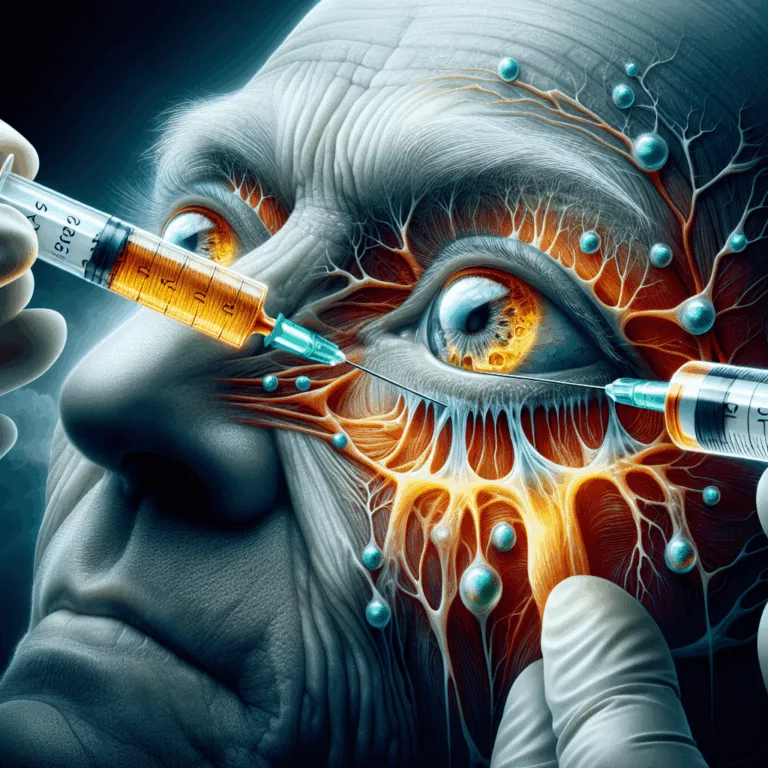
Découvrez comment des chercheurs inversent le déclin visuel lié à l’âge chez les souris grâce à l’injection de lipides dans la rétine.

Découvrez comment l’ingénierie des mitochondries pourrait transformer la médecine anti-âge en améliorant la fonction cellulaire.
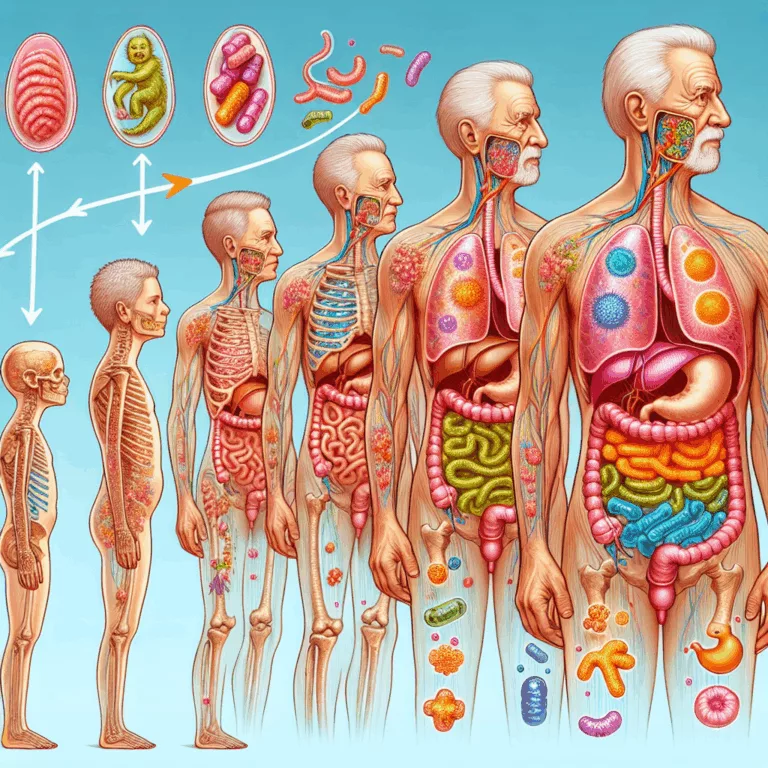
Découvrez comment le microbiome intestinal influence la santé et le vieillissement, et les innovations prometteuses dans ce domaine crucial.

Découvrez comment le canagliflozine influence le vieillissement cérébral et le potentiel de lutte contre la maladie d’Alzheimer chez les souris.

Découvrez comment les dernières innovations médicales ciblent les mécanismes du vieillissement pour améliorer la longévité et la santé des personnes âgées.