L’Inflammation Chronique et la Maladie d’Alzheimer : Vers une Nouvelle Compréhension
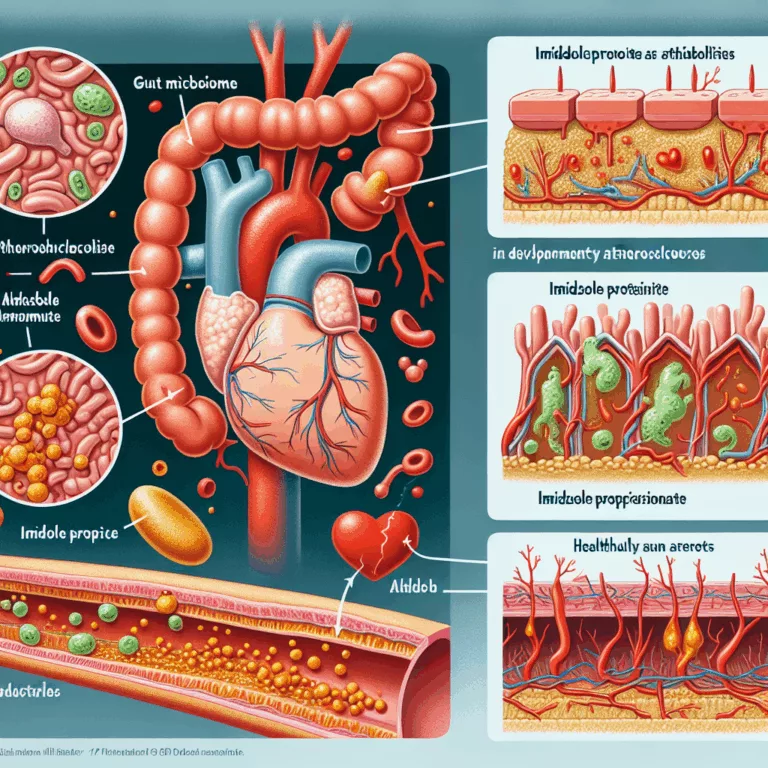
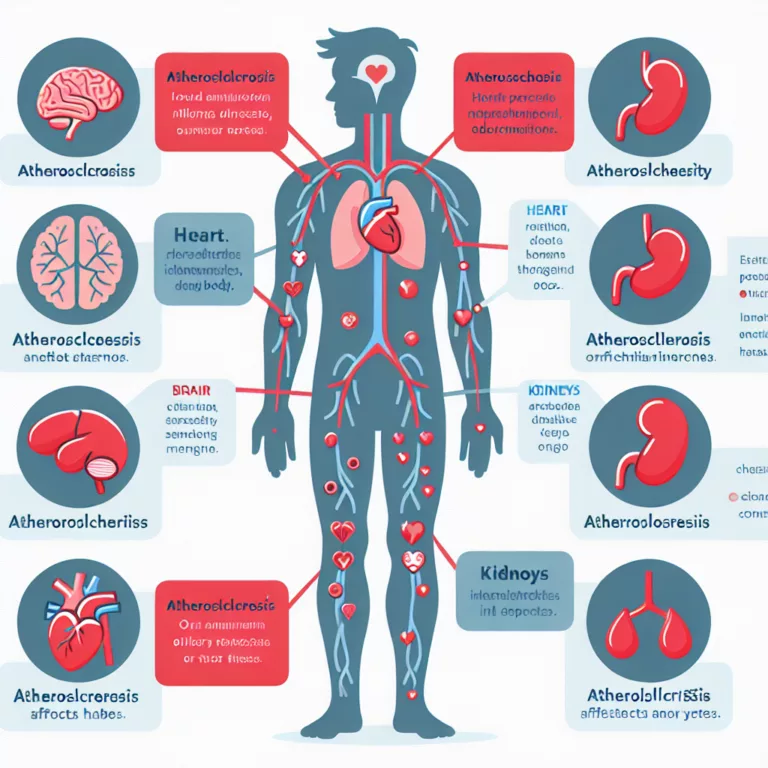
L’inflammaging, une inflammation continue et non résolue, est un phénomène observé dans toutes les pathologies liées à l’âge, et particulièrement dans le cerveau. Lorsqu’elle est prolongée, cette signalisation inflammatoire perturbe la structure et la fonction des tissus, contribuant ainsi à la dysfonction et à la mortalité. Cet article se concentre spécifiquement sur le rôle de…