La Dérive Mésenchymateuse : Un Nouveau Chemin vers le Rajeunissement Cellulaire
Découvrez comment la dérive mésenchymateuse et les facteurs Yamanaka ouvrent la voie au rajeunissement cellulaire et à la régénération des tissus.
Découvrez comment la dérive mésenchymateuse et les facteurs Yamanaka ouvrent la voie au rajeunissement cellulaire et à la régénération des tissus.

Découvrez comment le partenariat entre TruDiagnostic et Infinite Epigenetics révolutionne l’accès aux tests épigénétiques pour une santé préventive personnalisée.
Introduction Le coût abordable des outils omiques, associé à la capacité de distinguer le comportement des cellules individuelles à partir d’échantillons de tissus, permet de créer des bases de données de plus en plus grandes sur les profils épigénétiques et transcriptionnels du cerveau vieillissant. Bien que la création de ces bases de données soit intéressante,…

Découvrez comment les biomarqueurs révolutionnent la médecine de longévité avec le Dr Joseph Raffaele au Global Longevity Summit 2025 à Genève.
Les niveaux d’oxytocine circulante diminuent avec l’âge, et des recherches ont montré que restaurer des niveaux d’oxytocine jeunes a des effets bénéfiques sur des modèles animaux âgés. L’oxytocine est produite dans l’hypothalamus, et il existe une variété de mécanismes de livraison qui pourraient remplacer cette source. Dans cette étude, les chercheurs ont utilisé une voie…

L’infection persistante par le VIH, le virus de l’herpès ou d’autres pathogènes capables d’échapper ou de subvertir le système immunitaire peut être considérée comme un facteur d’accélération du vieillissement. Les dysfonctionnements causés par ces infections touchent principalement le système immunitaire, ce qui a des répercussions négatives sur le fonctionnement des tissus et des systèmes dans…

Arthur Clément, spécialiste de la longévité et membre de la Healthy Longevity Medicine Society, aborde les interventions basées sur des preuves pour prolonger la durée de vie en bonne santé. Bien que l’espérance de vie moyenne augmente, l’espérance de vie en bonne santé ne suit pas le même rythme, entraînant des périodes prolongées de morbidité…
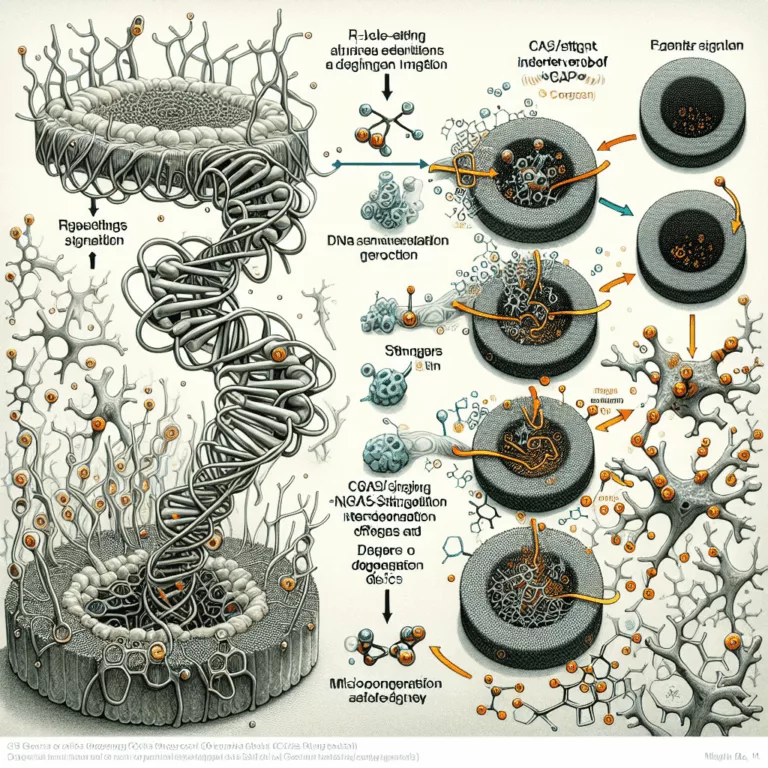
Le texte aborde les divers aspects de la structure de l’ADN nucléaire et son impact sur l’expression génique, en se concentrant sur le rôle des marques épigénétiques et des structures temporaires comme les R-loops. Les R-loops se forment lorsque des séquences d’ARN se fixent à l’ADN double brin, potentiellement en raison d’échecs de transcription, ce…

Le débat sur l’impact des médicaments agonistes des récepteurs GLP-1, comme le sémaglutide, sur les mécanismes du vieillissement, indépendamment de la perte de poids, est un sujet d’intérêt croissant. Les récepteurs GLP-1, présents dans divers organes, y compris le cerveau, soulèvent la possibilité de résultats au-delà de la réduction de l’appétit et de l’apport calorique….
Le texte présente un aperçu des projets de thérapie génique visant à traiter le vieillissement, tout en soulignant les limitations actuelles des vecteurs utilisés pour la délivrance des traitements. Malgré des avancées dans la technologie de thérapie génique, les vecteurs ont des difficultés à livrer des charges utiles de manière efficace dans tout le corps,…