L’impact de l’excès de tissu adipeux sur la progression de la maladie d’Alzheimer
Découvrez comment l’excès de tissu adipeux influence la progression de la maladie d’Alzheimer et son lien avec l’inflammation et la neurodégénérescence.
Découvrez comment l’excès de tissu adipeux influence la progression de la maladie d’Alzheimer et son lien avec l’inflammation et la neurodégénérescence.

Le texte aborde l’accumulation aléatoire des mutations dans l’ADN nucléaire, qui s’intensifie avec l’âge. Malgré l’efficacité des mécanismes de réparation de l’ADN, une partie des dommages causés par des interactions moléculaires et des radiations échappe à cette réparation, ce qui suscite des débats quant à l’impact de ces mutations sur le vieillissement dégénératif. Le consensus…
La maladie hépatique associée à la dysfonction métabolique (MASH) est une affection qui survient après une stéatose hépatique, principalement causée par l’obésité et aggravée par le vieillissement. Cette condition entraîne une dysfonction du tissu hépatique, ce qui se traduit par un fardeau croissant de fibrose et une perte de fonction hépatique. Dans la fibrose, les…
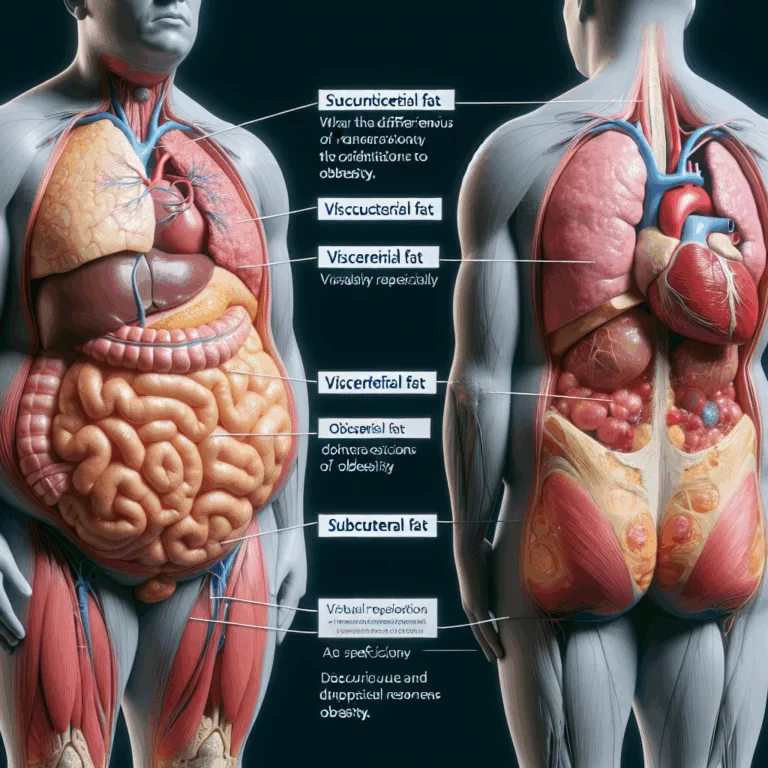
Les scientifiques ont découvert que la graisse viscérale, qui s’accumule autour des organes dans l’abdomen, et la graisse sous-cutanée, qui s’accumule sous la peau, réagissent différemment à l’obésité chez les souris mâles et les patients humains, et ont identifié un régulateur clé de ces processus. Des études épidémiologiques ont montré une corrélation plus forte entre…

Tenvie Therapeutics, une biotech américaine basée à South San Francisco, a été lancée avec un financement de 200 millions de dollars pour développer de nouveaux traitements visant à traiter les maladies neurologiques, cardiométaboliques et ophtalmiques. La société a acquis des programmes de petites molécules ainsi qu’une équipe de découverte de Denali Therapeutics pour se concentrer…