Isaac Health et LillyDirect : Une Révolution dans l’Accès aux Soins Spécialisés pour Alzheimer
Découvrez comment Isaac Health et LillyDirect améliorent l’accès aux soins spécialisés pour Alzheimer grâce à la télémédecine.

Découvrez comment Isaac Health et LillyDirect améliorent l’accès aux soins spécialisés pour Alzheimer grâce à la télémédecine.

Neu Health s’implante aux États-Unis grâce au programme GIP. Découvrez comment cette innovation en neurologie de précision transforme le traitement des maladies.

Découvrez comment la pollution de l’air influence la démence et les maladies neurodégénératives, révélant des liens inquiétants pour notre santé.

Introduction Les maladies cardiovasculaires (MCV) et la démence représentent deux des défis de santé mondiaux les plus pressants, en particulier dans les pays à revenu faible et intermédiaire. Des études épidémiologiques démontrent une forte corrélation entre l’incidence des MCV et celle de la démence. Cette relation suggère qu’il existe un mécanisme causal possible, comme la…
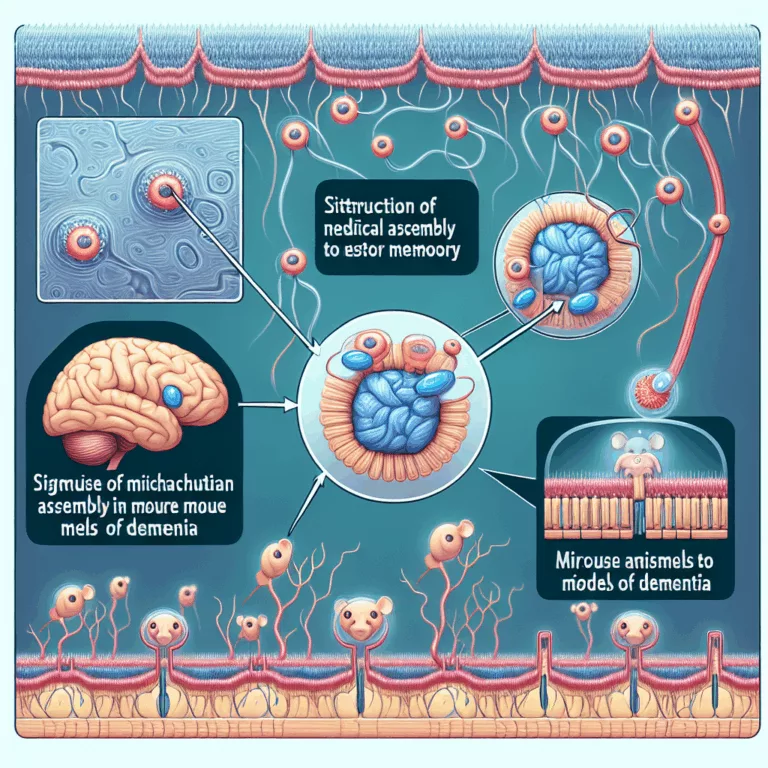
Des scientifiques ont découvert un moyen de stimuler directement l’assemblage du Complexe I dans les mitochondries, permettant de sauver des déficits de mémoire dans des modèles murins de la maladie d’Alzheimer et de la démence frontotemporale. De nombreuses maladies neurodégénératives, comme la maladie d’Alzheimer, sont associées à un dysfonctionnement mitochondrial, ce qui pourrait entraîner un…

L’inflammaging, une inflammation continue et non résolue, est un phénomène observé dans toutes les pathologies liées à l’âge, et particulièrement dans le cerveau. Lorsqu’elle est prolongée, cette signalisation inflammatoire perturbe la structure et la fonction des tissus, contribuant ainsi à la dysfonction et à la mortalité. Cet article se concentre spécifiquement sur le rôle de…

Ce mois-ci, le Milken Institute, un groupe de réflexion axé sur la santé, la finance et la philanthropie, a publié son rapport intitulé ‘Mind the Gap’, soulignant un défi mondial pressant : le rôle de la démence dans l’écart entre la durée de vie et la durée de vie en bonne santé. Bien que les…
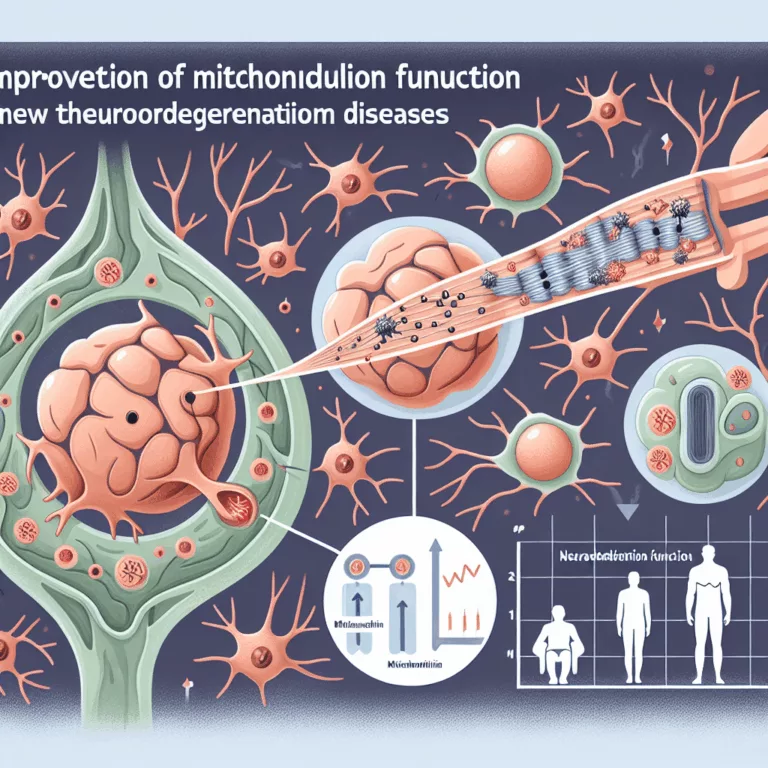
Les mitochondries sont des organites essentiels responsables de la production d’ATP, la molécule qui stocke l’énergie chimique nécessaire aux processus biochimiques. Considérées comme les descendants lointains de bactéries symbiotiques, chaque cellule humaine abrite des centaines de mitochondries. Avec l’âge, la fonction mitochondriale diminue pour diverses raisons complexes, notamment des dommages, des modifications de l’expression génique…
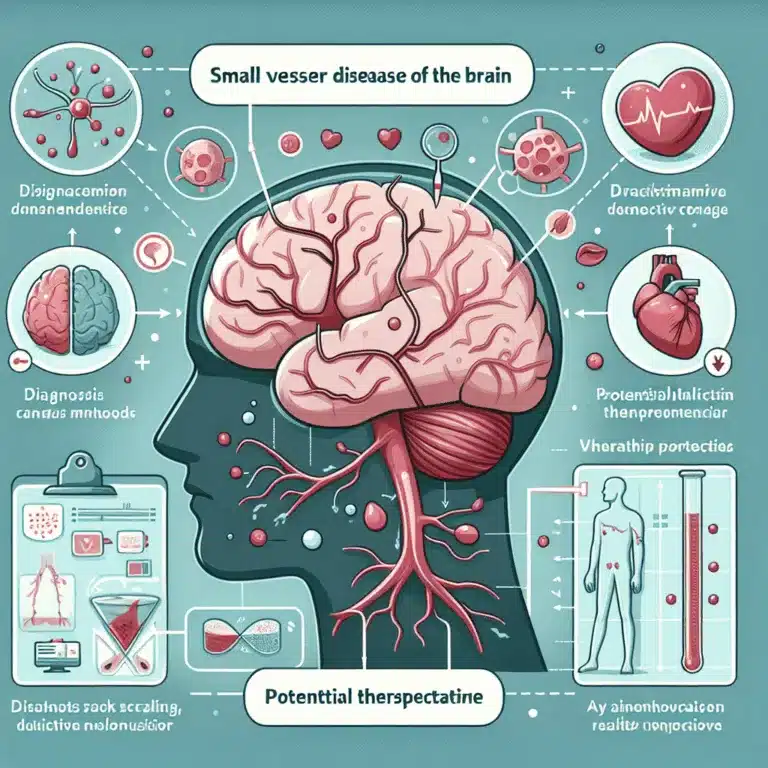
La maladie des petits vaisseaux cérébraux (cSVD) se réfère à des dysfonctionnements significatifs des petits vaisseaux sanguins du cerveau, englobant des conditions telles que la dysfonction endothéliale, les fuites de la barrière hémato-encéphalique, le raidissement des vaisseaux et les dommages causés par des ruptures mineures de vaisseaux. Les cliniciens diagnostiquent généralement la cSVD chez des…

La société Alamar Biosciences, spécialisée dans la protéomique de précision, s’est associée au Centre allemand des maladies neurodégénératives (DZNE) pour appliquer sa technologie à l’une des études de vieillissement basées sur la population les plus complètes au monde, l’étude Rhineland. Cette collaboration permettra aux chercheurs d’analyser 23 000 échantillons de plasma à la recherche de…